 „ALGEBRUSH II” jest to bardzo przydatne narzędzie do zdejmowania chorego nabłnka rogówki, usuwania martwaków u kotów. Można je także wykorzystywać do wyjmowania ciał obcych z rogówki, w tym metalowych.
„ALGEBRUSH II” jest to bardzo przydatne narzędzie do zdejmowania chorego nabłnka rogówki, usuwania martwaków u kotów. Można je także wykorzystywać do wyjmowania ciał obcych z rogówki, w tym metalowych.

ELEKTROEPILACJA NIEPRAWIDŁOWYCH RZĘS.
Nieprawidłowe rzęsy określane są terminem: dwurzędowość rzęs (distichiasis), rzęsy ektopowe (ectopic cilia), nieprawidłowe ułożenie rzęs (trichiasis). Wszystkie te rzęsy powodują drażnienie rogówki i zwykle prowadzą do jej uszkodzeń. Leczenie nieprawidłowości rzęs polega na ich usunięciu. Jednym ze skuteczniejszych sposobów ich usunięcia jest zabieg elektroepilacji. Polega on na niszczeniu torebki włosa na drodze elektrolizy. W Przychodni naszej stosujemy elektroepilację przyrządem SkinMate produkcji UK.
Dr n. wet. Przemysław K. Bryła
Przychodnia weterynaryjna w Warszawie
TRABECULECTOMY SURGERY IN THE TREATMENT OF GLAUCOMA IN DOGS
Aqueous humor is produced by the ciliary body by active secretion and filtration of plasma. Most of the aqueous humor flows from the posterior chamber, through the pupil, to the anterior chamber, and goes out at the iridocorneal angle into the intrascleral venous plexus. The balance between formation and drainage maintains intraocular pressure. In glaucoma the pressure in the eye increased. Prolonged or recurrent elevation of intraocular pressure lead to degeneration of the retina and optic nerve. The presence of a “red eye”, corneal edema, mydriasis, blepharospasm, blidness, and buphtalmos can be seen. Pupillary light reflex may be slow or absent.
Glaucoma is divided into primary (including congenital) and secondary categories. The iridocorneal angle may be open, narrow or closed in either type. Secondary glaucoma is most frequently due to severe anterior uveitis or iris melanoma. Aggressive medical and possibly surgical therapy is indicated for patients with glaucoma that continues to progress despite use of medications therapy. In some cases, trabeculectomy surgery may be recommended. This procedure we applied in the case of our patient.
KEYWORDS: trabeculectomy, primary glaucoma, secondary glaucoma, open angle, closed angle, intraocular pressure
SŁOWA KLUCZOWE: TRABEKULEKTOMIA, IRYDOTOMIA, JASKRA, CIŚNIENIE ŚRÓDOCZNE, CHIRURGICZNE LECZENIE JASKRY, OTWARTY KĄT PRZESĄCZANIA
Jaskra to grupa chorób oczu, w których na skutek podwyższonego ciśnienia wewnątrzgałkowego dochodzi do upośledzenia procesu widzenia (1). Jaskra powstaje w wyniku zaburzonego odpływu cieczy wodnistej, przy równoczesnym procesie jej stałego wydzielania. Wzrost objętości cieczy wodnistej przekłada się na wzrost ciśnienia wewnątrzgałkowego. Zwiększone ciśnienie jest jednym z czynników, które prowadzi do niszczenia komórek zwojowych siatkówki i nerwu wzrokowego (2).
WYTWARZANIE I ODPŁYW CIECZY WODNISTEJ.
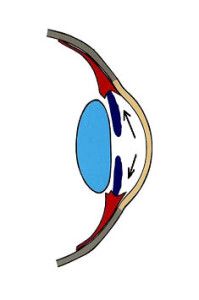
Ryc. 1. Drogi odpływu cieczy wodnistej.
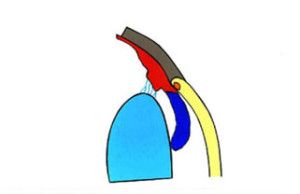
Krążenie cieczy wodnistej w oku oparte jest głównie na zasadzie grawitacji i konwekcji. Ruchy głowy oraz różnice temperatur pomiędzy rogówką a wnętrzem oka wywierają też duży wpływ na jej krążenie. Natomiast nieznaczną rolę pełni tu transport aktywny (2). Ciecz wodnista z komory tylnej oka, poprzez otwór źreniczny, przepływa do przedniej komory oka, aby dalej poprzez kąt przesączania ujść do zatoki żylnej twardówki (3), (Ryc.1.). Taki sposób odpływu cieczy wodnistej nazywany jest drogą konwencjonalną, jest to główna droga, którą odpływa około 90% cieczy wodnistej. Pozostałe 10% odpływa drogą naczyniówkowo-twardówkową, zwaną niekonwencjonalną, która polega na przepływie cieczy przez ciało rzęskowe do przestrzeni nadnaczyniówkowej i drenowaniu jej przez krążenie żylne w ciele rzęskowym, naczyniówce i twardówce (2).
Przestrzeń zawarta pomiędzy tylną obwodową powierzchnią rogówki a przednią nasadą tęczówki tworzy kąt przesączania, którego konfiguracja związana jest z patogenezą jaskry. Do badania i analizy kąta przesączania służy gonioskopia. Gonioskop to niewielki przyrząd optyczny nakładany po znieczuleniu oka bezpośrednio na rogówkę, umożliwia on identyfikację patologicznych struktur kąta i ocenę jego szerokości (4). Kąt przesączania tęczówkowo – rogówkowy składa się z więzadeł grzebieniastych (pectinate ligaments), szczelin rzęskowych (ciliary cleft), siateczki beleczkowej (trabecular meshwork) i kanałów odprowadzających ciecz wodnistą do żył zatoki żylnej twardówki. Więzadła grzebieniaste to różnych kształtów i rozmiarów wyrostki tęczówki, które penetrują obwodową rogówkę na granicy z twardówką. Pełnią one rolę filarów tkanki naczyniowej w kącie przesączania. Wysokość więzadeł grzebieniastych warunkuje stopień szerokości kąta przesączania. Im więzadła wyższe, tym kąt przesączania szerszy. Szerokość tego kąta jest istotna dla procesu odpływu cieczy wodnistej (5,6). Wolne przestrzenie w ciele rzęskowym zwane szczelinami, tworzą zachyłki, w których ma swój początek siateczka beleczkowa. Zbudowana jest ona z licznych warstw kolagenu i elastyny pokrytych płaskim śródbłonkiem. Siateczka beleczkowa pełni rolę filtru w kącie przesączania. Szczeliny zlewają się w kanały, które łącząc się ze sobą uchodzą do systemu żył oka (6), (Ryc.2.).

Ryc. 2. Budowa kąta przesączania tęczówkowo-rogówkowego.
Przednia i tylna komora oka wypełnione są przezroczystym płynem, zwanym cieczą wodnistą. Stałość składu chemicznego i właściwości fizycznych cieczy wodnistej zapewnia bariera komorowo – naczyniowa. Podłożem strukturalnym tej bariery jest śródbłonek naczyń włosowatych tęczówki i nabłonek ciała rzęskowego, które jest rodzajem gruczołu rozpościerającym się jak kryza wokół tylnej komory oka (7). Składa się ono z części przedniej – sfałdowanej i z części tylnej – płaskiej. Część sfałdowana zbudowana jest z promieniście ułożonych wyrostków, skierowanych w stronę tylnej komory oka, pokrytych nabłonkiem barwnikowym i nabłonkiem pozbawionym barwnika. Każdy z tych wyrostków ma centralnie przebiegającą tętniczkę, która kończy się bogatą siecią włośniczkową. Ścisłe połączenia pomiędzy sąsiadującymi komórkami warstwy pozbawionej barwnika stanowią barierę krew – ciecz wodnista (2). Ciecz wodnista jest aktywnie wydzielana przez nabłonek pozbawiony pigmentu w wyniku procesu metabolicznego, który zależy od działania wielu układów enzymatycznych, zwłaszcza od pompy ATP-azy sodowo-potasowej. W procesie tym znaczną rolę odgrywa enzym anhydraza węglanowa. Na skutek różnicy ciśnień osmotycznych w oku, dochodzi również do biernego przepływ płynu, ale proces ten u zwierząt odgrywa minimalną rolę w produkcji cieczy wodnistej (8, 9). Prawdopodobnie z wiekiem wielkość produkcji cieczy wodnistej maleje (8).
Krążenie krwi w błonie naczyniowej oka oraz wydzielanie cieczy śródocznych i ich prawidłowy przepływ zapewnia odpowiednie ciśnienie we wnętrzu gałki ocznej. Odpowiednio wysokie ciśnienie wewnątrzgałkowe konieczne jest do utrzymania optycznej krzywizny rogówki, gładkości jej powierzchni i stałego współczynnika załamania (7). Ciecz wodnista wypełniając przednią część oka odgrywa ważną rolę w stosunku do soczewki i rogówki. Elementy optyczne oka nie mają własnych naczyń krwionośnych, a rolę zaopatrzenia w tlen i składniki odżywcze spełnia tu ciecz wodnista (9). Ciśnienie śródoczne zależy od równowagi pomiędzy objętością tworzonego płynu, a jego odpływem. U psa za prawidłowe ciśnienie wewnątrz gałki ocznej przyjęto wartości poniżej 21 mmHg (3,10). Wartości te zależą między innymi od rasy, płci i wieku zwierzęcia jak również od metody pomiaru, doświadczenia osoby badającej. Pomiar ciśnienia śródgałkowego wykonuje się za pomocą tonometrów (11).
OBJAWY JASKRY
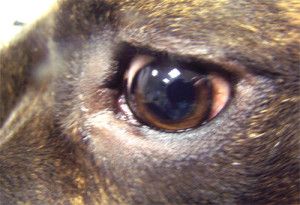
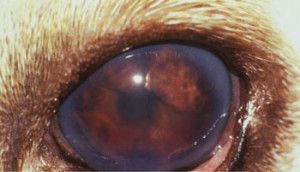
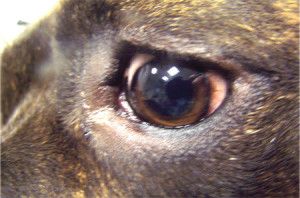
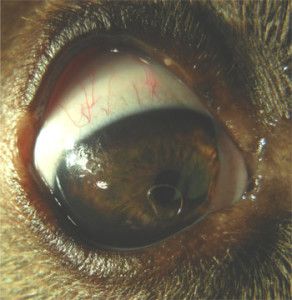
W ostrej fazie jaskry ciśnienie wewnątrzgałkowe nierzadko osiąga wartość 70 – 80 mmHg (12). Oko w takim stanie jest bolesne, co zwierzęta manifestują mrużeniem powiek, pocieraniem głową o przedmioty, czy też tarciem oka łapą. Obserwuje się nadmierne łzawienie, przekrwienie naczyń krwionośnych i obrzęk spojówek. Oko staje się „czerwone”. Zwierzęta tracą apetyt, są osowiałe, unikają światła i więcej śpią. W miarę postępu choroby gałka oczna powiększa się powodując powstanie woloocza (Fot.1.).

Fot. 1. Woloocze spowodowane wysokim ciśnieniem płynu śródocznego.
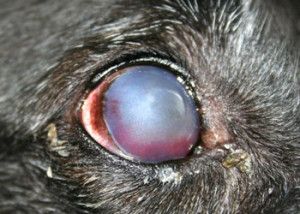
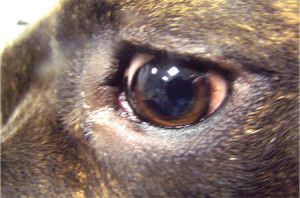
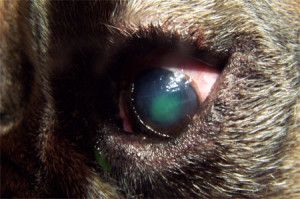
Na powiększonej gałce ocznej często nie domykają się powieki co zaburza pracę filmu łzowego i prowadzi do powstania licznych keratopatii. Na skutek obrzęku mętnieje powierzchnia rogówki i mogą pojawić się w niej mętne linie zwane liniami Haabs’a – są to wygojone pęknięcia błony Descemeta. Źrenice ulegają rozszerzeniu i zwykle słabo bądź wcale nie reagują na bodziec świetlny. Często obserwuje się anizoscorię – różne wielkości źrenic. W soczewce na skutek stagnacji krążenia tworzą się katarakty. Powiększenie objętości gałki ocznej narusza przyczepy soczewki, prowadząc do jej zwichnięcia lub przemieszczenia do komór oka. W wyniku zwiększonej przepuszczalności ścian naczyń włosowatych, do komór oka napływają cząsteczki białka, powodując zapalenie błony naczyniowej oka (uveitis) lub rzekome zapalenie błony naczyniowej oka (pseudouveitis). Zmiany charakterystyczne dla jaskry występują zazwyczaj w jednym oku, ale nie jest wykluczone występowanie ich równocześnie lub z pewnym opóźnieniem w obu oczach. Jaskra jest chorobą nieuleczalną i postępującą, która niszcząc nerw wzrokowy prowadzi do nieodwracalnej ślepoty (6,12,13,14,15).
RODZAJE JASKRY
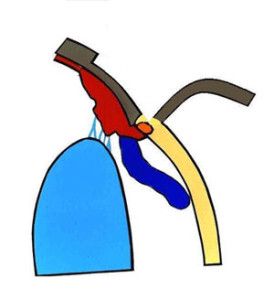
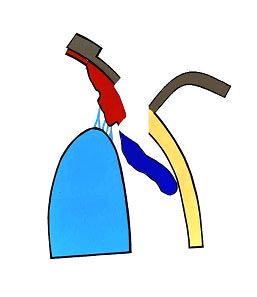
Nazwa jaskra obejmuje wiele jednostek chorobowych. Ponieważ patofizjologia, objawy kliniczne i leczenie różnych typów jaskry są różne, nie ma jednej definicji, która odpowiednio określałaby wszystkie jej odmiany, jednak ogólnie jaskrę podzielić możemy na pierwotną i wtórną. W praktyce klinicznej stosuje się również podział anatomiczny wynikający z budowy kąta przesączania. Wyróżniamy tu jaskrę z szerokim, otwartym kątem (Ryc.3.) i jaskrę z wąskim, zamykającym się kątem przesączania (Ryc. 4.), (2,12).
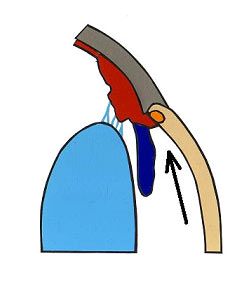
Ryc. 3. Otwarty kąt przesączania.
Ryc. 4. Zamknięty kąt przesączania.
Określenie jaskra pierwotna oznacza, że przyczyna, która powoduje utrudniony odpływ cieczy wodnistej z oka nie jest wynikiem żadnej innej choroby oka. Taki rodzaj jaskry przekazywany jest z rodziców na potomstwo. Rozwija się w obu oczach, choć najczęściej niesymetrycznie; proces chorobowy zajmuje najpierw jedno oko, a następnie drugie. Przyczyną jej jest goniodysgeneza elementów kąta tęczówkowo-rogówkowego (goniodysgeneza – wrodzona dysplazja elementów wchodzących w skład budowy kąta przesączania (15), oraz odkładanie się w nim glikoaminoglikanów. Prowadzi to do stopniowego zwężania się kąta przesączania (16).
Jaskra wtórna jest postacią jaskry powodowaną inną chorobą oczu np. urazem, zapaleniem, nowotworem lub chorobami ogólnymi, w przebiegu których wytwarza się w oku znacznie podwyższone ciśnienie śródgałkowe, powodujące uszkodzenie nerwu wzrokowego. Charakterystyczną cechą tej postaci jaskry jest występowanie zmian zazwyczaj w jednym oku. U zwierząt domowych najczęściej mamy do czynienia z jaskrą wtórną z wąskim lub zamkniętym kątem przesączania (3,12,15).Jaskra wtórna otwartego kąta wynika z patologii w obrębie utkania beleczkowego i dalszych dróg odpływu cieczy z oka. Najbardziej typowymi postaciami tej jaskry są : jaskra związana z uwalnianiem białek z przejrzałej soczewki (fakolityczna); jaskra barwnikowa, w przebiegu której drobiny melaniny uwolnione z tęczówki blokują odpływ w kącie przesączania; jaskra torebkowa, złuszczone komórki z torebki soczewki zatykają kąt przesączania; hemolityczna po wylewie krwi do oka; jaskra po urazach oka oraz jaskra polekowa. Tę ostatnią postać spotyka się po długotrwałym stosowaniu leków sterydowych. Dochodzi wówczas do zmiany struktury siateczki beleczkowej. Niekiedy jaskra rozwija się jako następstwo przebytej operacji oka, co może wynikać z uszkodzenia struktur oka i powstania blizn oraz zrostów. Ponadto w przebiegu zapaleń błony naczyniowej oka mogą tworzyć się zmiany bliznowate w rejonie kąta przesączania, prowadząc do jaskry (2,12, 17, 18).
Jaskra wtórna zamkniętego kąta wynika ze zmian w obrębie kąta przesączania, które w sposób mechaniczny utrudniają prawidłowy dostęp cieczy wodnistej do siateczki beleczkowej (12, 17). Przeszkodę tę mogą stanowić; patologiczna nasada tęczówki, guzy, nieprawidłowe naczynia, zrosty powstające w obrębie źrenicy, bądź zmiany związane z soczewką. Wyróżnić tu możemy kilka postaci jaskry: jaskrę fakotopiczną – wynikającą z przemieszczenia soczewki, jaskrę fakomorfotyczną powodowaną nieprawidłowym kształtem soczewki i jej pęcznieniem w przebiegu zaćmy (17, 18).
CHIRURGICZNE LECZENIE JASKRY
Celem leczenia jaskry jest utrzymanie funkcji widzenia na możliwie najlepszym poziomie. Lecząc jaskrę mamy możliwość wpływania tylko na ciśnienie panujące wewnątrz oka. Dla każdego zajętego przez jaskrę oka istnieje indywidualny poziom ciśnienia, który jest bezpieczny. Ten bezpieczny poziom ciśnienia nazywany jest ciśnieniem docelowym, które może się zmieniać w ciągu życia. W przypadku braku zahamowania choroby leczeniem farmakologicznym, należy zastosować zabiegi chirurgiczne zmniejszające produkcję cieczy wodnistej lub ułatwiające jej odpływ do przestrzeni podspojówkowej (12,15,19). Wszystkie zabiegi operacyjne mają na celu obniżenie ciśnienia w oku. Laserem można wykonać trabekuloplastykę – otwarcie przymkniętych otworków filtracyjnych w jaskrze otwartego kąta – oraz irydotomię, zabieg stosowany w jaskrze z wąskim kątem przesączania. Światłem laserowym wykonuje się mały otworek w tęczówce, który pozwala na przepływ cieczy wodnistej z tylnej komory oka do przedniej. Odpowiednim laserem można też zniszczyć ciało rzęskowe i w ten sposób zahamować produkcję cieczy wodnistej w oku (15). W przypadku braku lasera można wykonać trabekulektomię lub irydotomię chirurgiczną (20, 21, 22).
OPIS PRZYPADKU
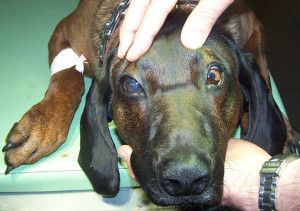
Do przychodni weterynaryjnej przy ulicy Hawajskiej trafił 5-letni pies rasy posokowiec bawarski u którego badaniem klinicznym stwierdzono jaskrę wtórną zamkniętego kąta. W dniu przyjęcia psa do przychodni ciśnienie płynu śródocznego miało wartość 38 mmHg, źrenica była maksymalnie rozszerzona i nie reagowała na światło. Z wywiadu wynikało, że stan taki trwał już od kilku dni. Pomimo wysokiego ciśnienia panującego wewnątrz oka nie doszło do uszkodzenia struktur odpowiedzialnych za widzenie. Natychmiast podjęto agresywne leczenie farmakologiczne (miejscowe i ogólne). Ogólnie podano Diuramid (Polfarma) 2 x dziennie po 125 mg, a do worka spojówkowego chorego oka wkraplano: Alphagen (Allergan), Cosopt (Merc Sharp & Dohme), Lotemax ( Bausch & Lomb/Dr Mann Pharma), Pilokarpinę (Polfa Warszawa) oraz Lumigan (Allergan) 4 x na dobę. Przez kolejne cztery dni nie uzyskano znaczącego obniżenia wartości płynu wewnątrzgałkowego. Ciśnienie wahało się w granicach 34-42 mmHg. Wobec powyższego postanowiono wykonać zabieg chirurgiczny. Standardem w praktyce weterynaryjnej wydaje się być trabekulektomia, która obniża ciśnienie wewnątrzgałkowe w wyniku wytworzenia kanału dla odpływu cieczy wodnistej z komory przedniej do przestrzeni pod torebkę Tenona (2, 21).
Na dzień przed zabiegiem u psa wykonano badanie kliniczne, elektrokardiograficzne oraz hematologiczne. Wyniki tych badań nie odbiegały od normy. (Fot.2.).
Fot. 2. Przygotowywanie psa do zabiegu trabekulektomii.
Zabieg trabekulektomii wykonano w znieczuleniu ogólnym dysocjacyjnym z zastosowaniem Bioketanu 100 mg/ml ( Vetoquinol) po uprzedniej premedykacji Xylapanem 20 mg mg/ml (Vetoquinol). Worek spojówkowy odkażono 0,2% roztworem jodyny. Po przykryciu miejsca operowanego samoprzylepnym polem operacyjnym i założeniu rozwieracza powiek przystąpiono do zabiegu trabekulektomii.
Ryc. 5. Odpreparowany powierzchowny płatek twardówki.
Operację przeprowadzono przy zastosowaniu mikroskopu operacyjnego firmy Seliga. Zabieg rozpoczęto odpreparowując spojówkę pokrywającą twardówkę. Odpreparowano ją od strony sklepienia górnego w kierunku rąbka rogówki. Następnie oczyszczono twardówkę z tkanki nadtwardówkowej. Na tak przygotowanej twardówce zaznaczono lekkim nacięciem prostokąt o wymiarach 3×4 mm. Jeden bok prostokątu stanowił rąbek rogówki. Kolejnym krokiem było nacięcie twardówki do połowy jej grubości i rozpoczęcie wytwarzania warstwowego płata twardówkowego w kierunku rąbka, aż do osiągnięcia przezroczystej rogówki. (Ryc. 5.).
U podstawy płatka nacięto rogówkę tak, aby uzyskać wejście do komory przedniej oka. Następnie za pomocą nożyczek Vannasa wycięto płatek głęboki twardówki o wymiarach 2×2 mm. W ten sposób uzyskano dostęp do kąta przesączania, którego fragment wraz z fragmentem obwodowym tęczówki usunięto. (Ryc. 6.).
Kolejnym etapem zabiegu było nałożenie powierzchownego płatka twardówki na swoje miejsce i przyszycie w taki sposób, aby płatek luźno przylegał do wypreparowanego łoża. Ostatnim etapem zabiegu było zaszycie uprzednio odpreparowanej spojówki. Następnie do komory przedniej oka przez paracentezę podano roztwór BSS, sprawdzając w ten sposób drożność przetoki oraz wytwarzając poduszkę filtracyjną. Podanie roztworu BSS miało również wytworzyć ciśnienie płynu śródocznego na poziomie ciśnienia docelowego. Zabieg trabekulektomii wykonano według opisu zamieszczonego w „Okulistyce Klinicznej” pod redakcją Jacka J. Kańskiego (2).
Ryc.6. Trabekulektomia z obwodową irydektomią.
Bezpośrednio po zabiegu pies otrzymał Enrobioflox inj. 5% (Vetoquinol) w dawce 3 ml oraz Metacam inj. (Boehring Ingelheim) w dawce 3 ml. Kontynuacja antybiotyku i NLPZ prowadzona była przez 7 dni po zabiegu. W dniu po operacji monitorowano ciśnienie śródoczne co 2, a następnie co 24 godziny przez kolejne dni. Zaobserwowano, że w dniu po zabiegu ciśnienie stopniowo obniżało się przyjmując wartości w granicach 9 – 19 mmHg. Następnego dnia wzrosło do 13 mmHg. Kolejne pomiary najpierw w odstępach 24, a następnie 48 godzinnych pokazywały wartości ciśnienia w granicach 13 – 25 mmHg. Gdy ciśnienie płynu wewnątrzocznego przekraczało wartość 25 mmHg, wówczas do oka podawano Cosopt (Merck Sharp & Dohme) 2 x dziennie po 1 kropli. Niestety po 3 tygodniach od zabiegu zauważono bliznowacenie pęcherzyka filtracyjnego, któremu towarzyszył wzrost ciśnienia śródocznego do wartości 38 mmHg. Żeby zapobiec bliznowaceniu powinno się podawać środki antymetaboliczne tj. 5-Fluorouracyl lub Mitomycynę (2, 21). Niestety, w trakcie zabiegu nie dysponowaliśmy w/w środkami. Leki te dostępne są na receptę i dopuszczone w Polsce do obrotu detalicznego. Wobec powyższych komplikacji podjęto kolejny raz agresywne leczenie farmakologiczne, które niestety nie powodowało spadku ciśnienia poniżej wartości 30 mmHg, a długotrwały wzrostu ciśnienia śródocznego ponad normę, spowodował uszkodzenie struktur odpowiedzialnych za widzenie. W takiej sytuacji jedynym skutecznym sposobem leczenia pozostało usunięcie chorej gałki ocznej.
PIŚMIENNICTWO
- Miller P.E., Pickett J.P., Majors U.: The efficacy of topical prophylactic antiglaucoma therapy in primary closed angle glaucoma in dogs; a multicenter clinical trials. J. Am. Hosp. Assoc. 2000, 36, 431-443.
- Kański J.J. : Okulistyka Kliniczna, Górnicki Wydawnictwo Medyczne, 2 wyd., Wrocław 2005, s. 192-269.
- Bedford P.G.C., Grierson I.: Aqueous drainage in the dog. Res. Vet. Sci. 1986, 41, 172-186.
- Martin C.L.: Gonioscopy and anatomical correlations of the drainage angle in the dog. J. Small Anim. Pract. 1969, 10, 171-184.
- Barrie K.P., Gum G.G., Samuelson D.A., Gelatt K.N.: Morphologic studies of uveoscleral outflow in normotensive and glaucomatous Beagles with fluorescein-labeled dextran. Am. J. Vet. Res. 1985, 46, 1, 89-97.
- Whiteman A.L.: Morphologic and immunohistochemical features of canine acute primary angle closure glaucoma. Invest. Ophtalmol. Vis. Sci. 2000, 41, 516-521.
- Bernat R.: Zmysł wzroku. W: Fizjologia człowieka z elementami fizjologii klinicznej. Wydana przez Traczyk W., Trzebski A. PZWL Warszawa 1980, s.109-110.
- Peiffer Jr R.L., Gellat K.N., Gum G.G.: Determination of the facility of aqueous humor outflow in the dog, comparing in vivo and in vitro tonographic and constant pressure perfusion technique. Am. J. Vet. Res. 1976, 37, 1473-1477.
- Barrie K.P., Gum G.G., Samuelson D.A., Gellat K.N.: Quantitation of uveoscleral outflow in normotensive and glaucomatous Beagels by 3-H labeled dextran. Am. J. Vet. Res. 1985, 46, 84-88.
- Miller P.E., Pickett J.P., Majors U.: In vivo and in vitro comparison of Mackay-Marg and Tono-pen applanation tonometers in dogs and cats. The nineteenth annual scientific program of the American College of Veterinary Ophtalmologists. Las Vegas, Nevada, 1988. Materiał pozyskany z internetu.
- TonoVet – Instrukcja obsługi i konserwacji. Przychodnia weterynaryjna w Warszawie, ul Hawajska 16. Materiał własny.
- Miller P.E.: Glaucoma; Diagnosis and Therapy. Waltham Symposium. Small Anim. Ophth. 2001. Materiały pozyskane z internetu, www.vin.com.
- Gelatt K.N., Gum G.G.: Inheritance of primary glaucoma in the Beagel. Am. J. Vet. Res. 1981, 42, 1691-1693.
- Smith R.I.E., Peiffer Jr. R.L., Wilcook B.P.: Some aspects of the pathology of canine glaucoma. Prog. Vet. Comp. Ophtalmol. 1993, 3 , 16-18.
- Brooks D.E.: Glaucoma in the dog and cat. Vet. Clin.North Am. Small Anim Pract. 1990, 20, 775-797.
- Ofri R.: Medical Therapy of Glaucoma. EJCAP. 2007, (17), 3, 285-288.
- Gelatt K.N., MacKay E.O.: Secondary glaucoma in the dog in North America. Vet. Ophtalmol. 2004, 7, 4, 243-259.
- Niżankowska M.H.: Jaskra. Przewodnik diagnostyki i terapii. Górnicki Wydawnictwo Medyczne. 2001, s.86-106, s.119-129.
- Miller P. E. Jaskra. W: Okulistyka weterynaryjna Slattera. Wydana przez Maggs , Miller P.E., Ofri R. ,Elsevier Wrocław 2009, s.255-274.
- Brooks D.E.: Current concepts in veterinary ophthalmology. 2003. Materiały pozyskane z internetu, http://sacs.vetmed.ufl.edu.
- Chen C. Teresa.: Glaucoma filtration surgery (Trabeculectomy). Digital Journal of Ophthalmology, August 18, 2012,www.djo.harvard.edu.
- Kopacz D., Maciejewicz P., Kęcik D.: Systemy filtrujące stosowane w leczeniu ciężkich przypadków jaskry. Okulistyka 1 (I), 2011, rok XIV.
Dr n. wet. Przemysław K. Bryla
Przychodnia weterynaryjna w Warszawie
brylapik@wp.pl
TRUDNOGOJĄCY SIĘ WRZÓD ROGÓWKI U PSA RASY BOKSER
ARTYKUŁ PRZEDSTAWIA PRZYPADEK LECZENIA WRZODU ROGÓWKI U PSA RASY BOKSER. WRZÓD TEN OKREŚLANY JEST TERMINEM „TRUDNOGOJĄCY SIĘ” LUB „INDOLENT ULCER”. WRZODY TEGO TYPU SĄ PREDYLEKCYJNE DLA NIEKTÓRYCH RAS PSÓW. POWSTAJĄ CZĘSTO SPONTANICZNIE I NIESTETY CZĘSTO MOGĄ NAWRACAĆ. ISTOTA CHOROBY POLEGA NA ODDZIELANIU SIĘ NABŁONKA ROGÓWKI OD JEJ ISTOTY WŁAŚCIWEJ. PRZYCZYNĄ TEGO MOŻE BYĆ WADA HEMIDESMOSOMÓW, KTÓRE ODPOWIADAJĄ ZA PRZYLEGANIE NABŁONKA DO STROMY LUB TEŻ PROCESY ZWYRODNIENIOWE STROMY ROGÓWKI. W OBRAZIE KLINICZNYM, PO WYBARWIENIU ROGÓWKI ZA POMOCĄ FLUORESCEINY, WIDOCZNE JEST PODCIEKANIE BARWNIKA POD WARSTWY ROGÓWKI. ISTNIJE KILKA METOD LECZENIA TEGO TYPU OWRZODZENIA. WYMIENIĆ NALEŻY; KERATOTOMIĘ, POWIERZCHOWNĄ KERATEKTOMIĘ, CHIRURGICZNE USUNIĘCIE MARTWEGO NABŁONKA ROGÓWKI. LECZENIU CHIRURGICZNEMU ZAWSZE TOWARZYSZY LECZENIE FARMAKOLOGICZNE. W NASZYM PRZYPADKU U PSA ZASTOSOWALIŚMY LECZENIE ZA POMOCĄ KERATOTOMII KRATKOWEJ SKOJARZONEJ Z LECZENIEM FARMAKOLOGICZNYM.
SUMMARY
A case of indolent ulcer in a Boxer is described. An indolent ulcer is a ulcer which fails to heal in the expected time. These ulcers are often breed-related, develop spontaneously and may be considered to represent a primary corneal epithelial or superficial stroma dystrophy. It is caused by a failure of attachment between the basal epithelium to the underlying membrane. There are several methods that will facilitate healing; debridement, keratotomy, superficial keratectomy and medical treatment.
KEYWORDS: Indolent ulcer, keratotomy, keratectomy, refractory ulcer, Boxer ulcer.
INTRODUCTION
The normal cornea is a clear transparent structure composed of several layers: epithelium, subepithelial basement membrane, stroma, Descement membrane and endothelium (1). I order to be transparent, the cornea has no blood vessels, lack of pigmentation and a preocular moisture film maintained nonkeratinized surface epithelium (2). The cornea achieves relative transparency at the end of gestation in the dog. Following eyelid opening at approximately 14 days postnatal in the dog, there is an initial decrease in corneal thickness, presumably as the corneal endothelium becomes functional (3). Corneal thickness varies from 0,45 to 0,55 mm centrally and from 0,5 to 0,65 mm in the periphery (2).
The cornea is richly supplied with sensory nerves, particularly pain receptors derived from the ophthalmic division of the trigeminal nerve. The most superficial layers are innervated with pain receptors, whereas more pressure receptors are found in the stroma. This explains why a superficial corneal injury is often more painful than a deeper wound (4).
The cornea serves two functions necessary for vision. First, must serve as a physical barrier of the eye against the external environment and must serve as the major refractory surface of the eye for retinal image formation ( 5).
The corneal epithelium is thick and is continuous with the conjunctiva. It exists as a simple, squamous, non-keratinized tissue at the surface with the basal cells becoming more columnar and attaching to the basement membrane via hemidesmosomes. In order to maintain smooth ocular surface the epithelium must continually rejuvenate. The half – life of the epithelial cell is 36-48 hours and the layer can completely replace itself every six to eight days (6).
Any injury involving the cornea can be described as an ulcer. Generally, corneal ulcers are described as superficial or deep, depending on whether they just involve the epithelium or they extend into the middle layer – the stroma (7).
Normally, ulcers involving only the epithelium heal quickly due to the layer’s rapid turnover rate. First, epithelial cells around the margin of the wound migrate into the defect in a leapfrog fashion within an hour of injury to cover the defect. Mitosis of the basal layer of cells is initially inhibited and typically begins within 24 hours of injury. The regeneration of the basement membrane occurs slowly and the adherence of the epithelium to the basement membrane via hemidesmosomes is complete for several weeks (5). Injuries that penetrate the stroma heal poorly and are usually refractory to medical therapy alone (1).
An indolent ulcer is an ulcer which fails to heal in the expected time, usually 5 – 7 days (8). Eye affected with indolent ulcers try to grow a new surface over the defect, but the incoming cells fail to stick down onto the layer underneath (stroma). As a result, a thin layer of loose tissue can be see surrounding the ulcerated area. The reason why the cells fail to stick is belived to be mainly because the epithelium cells fail to form tiny “feet” that normally hold on to the tissue underneath (7). The epithelium at the edge of an indolent ulcer is loose and underrun, unable to “stick down’ and heal the defect (9).Indolent ulcers are also known as chronic epithelial erosion, refractory superficial ulcer, Boxer ulcer, recurrent erosion, refractory epithelial erosion and epithelial basement membrane dystrophy (2). These ulcers are often breed-related, develop spontaneously and may eventually affect both eyes. They may be considered to represent a primary corneal epithelial or superficial stromal dystrophy. It is generally believed to be caused by a failure of attachment between the basal epithelium to the underlying membrane, which is either absent or abnormal (1). If no cause of mechanical irritation can be found, a physiological defect in the cornea is the cause of ulceration. There are two classes of corneal diseases: primary epithelial/basement membrane disease leading to loss of adherence of epithelium to stroma and primary endothelial disease leading to loss of regulation of deturgescence of the stroma (5). Primary endothelial disease is typically characterized by pronounced corneal edema and corneal opacity and lead to impairment of epithelial adherence due to the formation of bullae (bullous keratopathy) in the superficial stroma. These bullae can rupture and lift the epithelium from the stroma forming ulcerations (10).
Certain breed are predisposed to develop indolent ulcers : Boxers, Corgis, Staffordshire Bull Terriers and West Highland White Terriers are often affected. It is usually seen in middle aged to older dogs, without any sex predisposition and can occur in any canine breed. There is no known mode of inheritance (2). Once a dog has suffered an indolent ulcer in one eye, it may develop one in the other eye, or recurrence of ulceration in the first eye (7).
THE PURPOSE
The purpose of our report was to describe the diagnosis and treatment of an indolent ulcer in a Boxer dog.
CASE DESCRIPTION
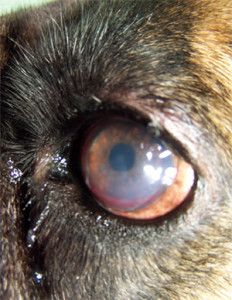
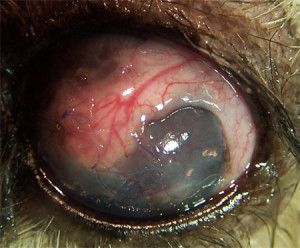
Photo 1. Indolent ulcer in 10 years Boxer (deep vascularisation, corneal edema)
A 10-years – old, male boxer, was examined at the Surgery, for a unilateral corneal ulcer of the left eye. The ulcer had been diagnosed one month previously by the other veterinarian and treatment had involved topical application of antibiotics, non-steroids agents and 1% atropine. The cause of the initial ulcer was unknown.
In our Surgery ophthalmic examination of the left eye revealed tearing and conjunctival hyperemia. Direct and indirect papillary light responses were normal. The anterior chamber was clear. Schirmer Tear Test (STT-1) in the left eye was 24 mm/min. and measured by Tono-Vet intraocular pressure in this eye was 18 mmHg. Corneal examination revealed big epithelial ulcer with nonadhered epithelium at the margin. In the cornea mild edema, deep vascularisation was observed. This was characterized by an ingrowth of deep blood vessels from the limbus. A delayed vascular response is often seen with chronic lesions (1). Indolent ulcers are usually quite uncomfortable and if left untreated they can persist for many months causing continuous irritation (8).
Dogs with indolent ulcers often manifest photophobia, blepharospasm and epifora (1). Sign of eye discomfort include weeping, blinking, squinting, pawing at the eye and general depression. (7).
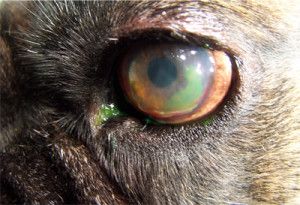
Photo. 2. Fluorescein dye migrates under a loose flap of epithelium.
DIAGNOSES
Indolent ulcers can be diagnosed by the appearance of a loose or redundant epithelial margin surrounding the ulcer and by eliminating other causes of superficial corneal ulcers. A fluorescein stain should be always done in the diagnosis. The dye will stain the ulcerated area and also will migrate under the loose flaps of the epithelium. Another test for an indolent ulcer is to rub the margins of a superficial ulcer gently with a dry cotton. If the loose epithelium can be stripped off the test is positive (1).
Differential diagnoses for the persistent epithelial ulcer, based on its clinical appearance, included indolent corneal ulcer, fungal and bacterial keratitis, keratoconjunctivitis sicca and the presence of ectopic cilia or a
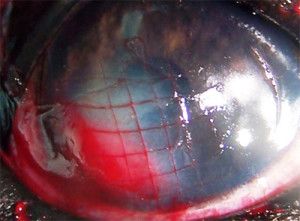
Photo 3. Grid keratotomy.
conjunctival foreign body (1).
TREATMENT
Treatment used for indolent ulcers include surgical epithelial debridement (mechanical or chemical management), grid or punctate keratotomy, keratectomy and medical management (antiprotease, antibiotic agents and non-steroidal anti-inflammatory drugs), (10).
Occasionally these treatments can be performed in some animals using local anaesthetic eye drops but often it is necessary to sedate the patients to avoid undue stress and inadvertent damage to the eye (8).
Our patient was nervous so we decided to sedate him. Microsurgical instruments and an operating microscope was used.
First, the diseased epithelium was debrided with a cotton swab soaked in betadine. The debridement starts at the apparent edge of the ulcer and then continues outwards to the thru edge. This procedures enlarges the original ulcer. After that, the linear (grid) keratotomy was performed. Grid keratotomy was selected because of its superior efficacy over punctate keratotomy (10). Keratotomy was done with a 25 gauge needle. Small parallel incision were made in a grid-like fashion through the epithelium and basement membrane. The purpose was to expose the underlying corneal stroma. Epithelial cells will migrate from these lines and will enhance adherence to the corneal stroma (1). Usually linear incision are placed 1-2 mm apart and must extend about 3 mm into the normal epithelium surrounding the ulcer.
Because of nervous dog we decided to used for 10 days temporal tharsorhapy to protect the cornea after surgery.
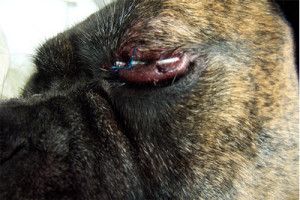
Photo 4. Temporary tharsorhaphy protect cornea after surgery.
Photo 5. Cornea 10 days after keratotomy.
Postoperative therapy consisted of systemic cefalexin 15 mg/kg DID and oral carprofen, 4 mg/kg q24h for ten days. Ophthalmic reexamination was performed ten days after surgery.
Debridement with keratotomy combined with temporary tharsorhaphy gave full success of healing indolent ulcer in this patient after one procedure. Most of the superficial ulcers heal without corneal vascularisation, although in same patients blood vessels may become visible at the limbus and continue to migrate across the cornea towards the lesion (1).
REFERENCES
- Janssens G. : Indolent ulcers in dog’ eyes. EJCAP, 2007, 17, 3, 280-283
- Samuelson D. A. : Ophthalmic Anatomy. W: Veterinary ophthalmology. Wydana przez Gelatt K. Blackwell Publishing 2007, vol. 1, s. 37-147.
- Montiani-ferreira F., et al.: Early postnatal development of central cornea thickness in dog. Vet. Ophthalmol. 2003, 6, 19- 21.
- Wolter J. : Innervation of the corneal epithelium of the eye at the rabit. Arch. Ophthalmol. 1957, 58, 248-256.
- Plant J. E. E. : Canine Degenerative Corneal Endothelium Disease and the Management of the Diseases in Private Practice. Senior Seminar Paper. Cornell University College of Veterinary Medicine. 2004, Febr. 11.
- Severin G. A. : Cornea. W: Severin’s veterinary ophthalmology notes. Wydana przez Mawhiney H., Fort Collins; GA Severin, 1995, 285-325.
- Willows Veterinary Centre & Referal Services : Recurrent Corneal Erosions. www.willows.uk.net/en-GB
- Meredyth L. J., Gilmour M. A., Streeter R. N.: Use of grid keratotomy for the treatment of indolent corneal ulcer in a llama. Can. Vet. J. 2007, 48, 416-419.
- Davies Veterinary Specialists : Non-healing (indolent) corneal ulcers in dog. www.vetspecialists.co.uk
- Whitley R. D., Gilger B. C. : Diseases of the canine cornea and sclera.W: Vetreinary ophthalmology. Wydana przez Gelatt K., Baltimore, Lippincott Williams & Wilkins, 1999, s. 635-662.
Dr Przemysław K. Bryła, PhD, BrAVO, Przychodnia weterynaryjna Warsaw, Poland
Dr David Gould, PhD, BSC, BVM&S, DVOphtal., DipECVO, MRCVS, RCVS, Davies Veterinary Specialists, Manor Farm Business Park, Higham Gobion, UK
INFLAMMATION OF THE UVEAL TRACT IN DOG
The uvea includes the iris, the ciliary body and the choroids. An inflammation of the uvea tract can be defined as uveitis. Uveitis is usually classified into anterior uveitis – involving the iris and ciliary body, intermediate uveitis and posterior uveitis – involving the choroid and retina. There are many known causes of uveitis e.g. (infections, trauma, parasites, immune-mediated, tumors). A specific etiological factor can not always be determined in spite of extensive laboratory investigations. Anterior uveitis presents as a painful red eye. Vision may be impaired, episcleral hyperaemia, corneal oedema, miosis and a swollen or hyperaemic iris are present. Inflammation of the anterior uvea breaks down the blood-aqueous for protein. The anterior chamber is often shallow and the intraocular pressure is low. Hyphaema and hypopyon may be present. Inflammatory deposits may adhere to the corneal endothelium (keratic precipitates). Anterior or posterior synechiae and secondary cataracts may develop. Intermediate uveitis release inflammatory material into the adjacent anterior vitreous (snowbanking). Posterior uveitis always extends to involve the adjacent retina. Fundic changes associated with choroidal inflammation are observed in the tapetal fundus. A large component of uveitis is immune mediated, with an host immune response. Therefore symptomatic treatment with corticosteroids and topical atropine is indicated. However, if corneal ulceration or perforation is present, then non-steroidal anti-inflammatory drug may be used. In case, where an infectious agent is found, the appropriate antimicrobial agent should be used. Occasionaly some immunosuppressive agents such as azathioprine or cyclosporine are required.
BŁONA NACZYNIOWA OKA PSA.
Błona naczyniowa gałki ocznej (tunica vasculosa bulbi), składa się z tęczówki, ciała rzęskowego i naczyniówki. Tęczówka, (iris) leży tylnie od rogówki. W środku tęczówki znajduje się źrenica (puppila). Na powierzchni przedniej i tylnej tęczówki widoczne są fałdy tęczówki. Brzeg ograniczający źrenicę nazywany jest brzegiem źrenicznym, a brzeg wzdłuż którego tęczówka przymocowana jest do ciała rzęskowego i do rogówki nazywany jest brzegiem rzęskowym. Tęczówka łączy się z rogówką za pomocą więzadła grzebieniastego kąta tęczówkowo-rogówkowego.
Więzadło to składa się z szeregu beleczek, pomiędzy którymi znajdują się szczeliny. Struktura ta nazywana jest kątem przesączania tęczówkowo-rogówkowym. Na powierzchni i w zrębie tęczówki występują liczne melanocyty, nadające oczom indywidualny kolor. W tęczówce występują mięśnie. Miocyty ułożone okrężnie tworzą mięsień zwieracz źrenicy, a komórki mioepitelialne ułożone promieniście, mięsień rozszerzający źrenicę. Wpływają one na kształt i wielkość źrenicy, a tym samym odpowiadają za ilość promieni świetlnych przenikających do wnętrza gałki ocznej. Mięsień zwieracz unerwiony jest przez włókna przywspółczulne odchodzące od zwoju rzęskowego. Natomiast mięsień rozwieracz źrenicy, położony tylnie w stosunku do mięśnia zwieracza źrenicy, unerwiony jest przez włókna współczulne wywodzące się ze zwoju szyjnego doczaszkowego (1, 2). Z klinicznego punktu widzenia mięśnie zwierające źrenicę mają większe znaczenie (3).
Ciało rzęskowe, (corpus ciliare) leży tylnie od tęczówki i ma postać kilkumilimetrowej szerokości pierścienia. Rusztowanie jego tworzy łącznotkankowa blaszka podstawna przyczepiona do twardówki. W ciele rzęskowym wyraźnie widoczne są promieniście ułożone, w liczbie około 100, wyrostki rzęskowe. Tworzą one wieniec rzęskowy. Pomiędzy tymi wyrostkami występują wzniesienia określane mianem fałdów rzęskowych. Do wyrostków rzęskowych przytwierdzają się włókna obwódkowe podwieszające soczewkę. Istotnym elementem ciała rzęskowego jest mięsień rzęskowy. Tworzą go miocyty gładkie przebiegające w dwóch kierunkach; południkowym i okrężnym. Pierwsze z nich przyczepiają się do twardówki. Drugie natomiast są traktowane jako właściwy mięsień rzęskowy. Rolą ciała rzęskowego jest oddziaływanie na kształt soczewki (akomodacja soczewki) oraz produkcja cieczy wodnistej oka (1, 2). Naczyniówka, (choroidea) stanowi tylny fragment błony naczyniowej. Jest to cienka, bogato pigmentowana struktura. Wyróżnia się w niej kilka warstw. Pierwsza z nich, przylegająca do powierzchni twardówki, nosi nazwę blaszki nadnaczyniówkowej. Kolejna warstwa to blaszka naczyniowa. Pomiędzy blaszką naczyniową a blaszką naczyń włosowatych znajduje się błona odblaskowa, zwana makatką odblaskową. U psa ma ona budowę komórkową i odpowiada za potęgowanie bodźców świetlnych we wnętrzu oka. Kolejną warstwą naczyniówki jest blaszka podstawna, która przylega do siatkówki. Rolą naczyniówki jest zapewnienie ciągłości procesom życiowym w siatkówce (1, 2).
MIKROŚRODOWISKO IMMUNOLOGICZNE OKA.
Na odpowiedź immunologiczną oka wpływają liczne struktury anatomiczne gałki ocznej. Komora przednia gałki ocznej jest jamą wypełnioną cieczą wodnistą, która krążąc, odpowiada za komunikację pomiędzy poszczególnymi jej elementami. Ciecz wodnista zawiera kompleksową mieszankę czynników biologicznych między innymi, takich jak; cytokiny, mediatory, neuropeptydy, składowe dopełniacza, komórki immunologicznie kompetentne wpływające na procesy immunologiczne zachodzące w gałce ocznej (3). W oku istnieje bariera krew/narząd wzrokowy (4). Obecne w ciele rzęskowym kapilary okienkowe pozwalają na powstanie gradientu makrocząsteczek osocza. Mniejsze cząsteczki obecne są w cieczy wodnistej w większym stężeniu niż większe cząsteczki. Ścisłe połączenia pomiędzy barwnikowym i bezbarwnym nabłonkiem rzęskowym zapobiegają przenikaniu makrocząsteczek z osocza do cieczy wodnistej. Jednak niewielka ilość takich cząsteczek może przekraczać tą barierę i na drodze dyfuzji przenikać błonę naczyniową przez przednią powierzchnię tęczówki (4). W gałce ocznej brak jest rozwiniętego układu chłonnego. Usuwanie cząsteczek odbywa się na zasadzie endocytozy przez komórki śródbłonkowe sieci beleczkowej lub makrofagi, a rozpuszczalne cząsteczki wraz z cieczą wodnistą przepływają kanałami odprowadzającymi ciecz wodnistą (2). Tęczówka i ciało rzęskowe zawierają makrofagi i komórki dendrytyczne, które odgrywają rolę komórek prezentujących antygeny (APCs) i potencjalnych komórek efektorowych (3,4).
W prawidłowym przednim odcinku gałki ocznej obecne są nieliczne, osiadłe komórki T i mastocyty. Przednia błona naczyniowa ma układ immunoregulatorowy określany jako uprzywilejowany immunologicznie. Oznacza to, że implantacja guza lub obcego przeszczepu lepiej przeżywa w takim uprzywilejowanym obszarze podczas, gdy w skórze (rejon nieuprzywilejowany) podobny implant lub przeszczep jest gwałtownie odrzucany przez mechanizmy immunologiczne (5). W uprzywilejowaniu immunologicznym pośredniczą obie fazy łuku odpowiedzi immunologicznej – aferentna i efektorowa. Immunizacja wykorzystująca przedni odcinek jako fazę aferentną prowadzi do generacji efektorów immunologicznych. Antygen w przedniej komorze oka indukuje fazę aferentną, w której uczestniczą makrofagi osiadłe w tęczówce, rozpoznające i pochłaniające go. Stymulowane antygenem makrofagi opuszczają oko poprzez sieć beleczkową i kanały odprowadzające nadmiar cieczy wodnistej. Następnie drogą krążenia układowego docierają do śledziony. Tutaj w procesie aktywacji pomocniczych i supresorowych komórek T oraz komórek B następuje przekształcenie sygnału antygenowego. Wynikiem tego procesu jest immunologiczna odpowiedź efektorowa, w której możemy wyróżnić trzy kategorie. Zaliczamy tu; wrodzoną i adaptacyjną immunologiczną odpowiedź efektorową oraz mechanizmy amplifikacji odpowiadające obu typom odpowiedzi immunologicznej. Wrodzoną odpowiedź immunologiczną zapoczątkowują czynniki wydzielane przez bakterie (lipopolisacharydy, egzotoksyny, składniki ściany komórkowej), nieswoiste cząstki efektorowe (enzymy wydzielane do osocza, białka ostrej fazy), aktywacja neutrofilów i makrofagów (adhezja, transmigracja, fagocytoza). Adaptacyjna immunologiczna odpowiedź efektorowa zależna jest od przeciwciał, limfocytów oraz od kombinacji odpowiedzi przeciwciał i komórkowych mechanizmów efektorowych np. cytotoksyczność komórkowa zależna od przeciwciał. W większości przypadków efektory te inicjują proces, który musi być wzmocniony, by wywołać odpowiednie objawy chorobowe. Za wzmocnienie tego procesu odpowiedzialne są cząsteczki określane mianem mediatorów zapalenia. Większość z nich oddziałuje na komórki docelowe poprzez receptory. Możemy wyróżnić tu ; surowicze układy enzymatyczne (składowe dopełniacza, układ kinin, włóknik), wazoaktywne aminy (serotonina, histamina), mediatory lipidowe (eikozanoidy, czynniki aktywujące płytki krwi), cytokiny, reaktywne substancje tlenowe, reaktywne produkty azotowe oraz produkty ziarnistości neutrofilów (3,4,5).
Dopełniacz jest ważnym mediatorem zapalnym oka. Oba typy odpowiedzi immunologicznej prowadzą do wytwarzania jego składowych; na drodze klasycznej bądź alternatywnej. Funkcja dopełniacza polega na opłaszczaniu antygenów lub powierzchni patogenów przez C3b w celu zwiększenia fagocytozy. Poprzez atak dopełniacza na błonę komórkową wzmaga się jej liza. Dopełniacz indukuje zapalenie również przez wytwarzanie anafilatoksyn (6). Najbardziej znanym produktem kinin jest bradykinina. Przyczynia się ona do wielu efektów zapalnych tj. zwiększenie przepuszczalności kapilarów, skurczu mięśni gładkich, reakcji bólowej. Włóknik jest końcowym produktem przemian surowicy. Odkładanie jego prowadzi między innymi do homeostazy, angiogenezy, adhezji leukocytów. Złogi włóknika w oku powodują wiele powikłań, takich jak zrosty, powstawanie cyklicznych błon i odwarstwienia siatkówki. Aminy takie jak serotonina i histamina odpowiadają za skurcz mięśni gładkich, silnie zwiększają przepuszczalność kapilarów i przepływ krwi. Histamina wpływa dodatnio na wytwarzanie cytokin oraz ekspresję receptorów na leukocytach (3, 6). Rolę istotnych mediatorów i regulatorów odpowiedzi immunologicznej odgrywają dwie grupy cząsteczek lipidowych – eikozanoidy i czynniki aktywujące płytki (PAFs). Najważniejszą rolę w procesie zapalnym w gałce ocznej pełnią prostaglandyny (PGs). Regulują przepuszczalności naczyń krwionośnych oka oraz odziaływują na regulacją alternatywnych dróg odpływu cieczy wodnistej (2, 6). Cytokiny są sztucznym pojęciem określającym różne rozpuszczalne mediatory polipeptydowe, syntetyzowane i wydzielane przez komórki w celu przekazywania sygnałów komunikacji międzykomórkowej. Interakcje cytokin mogą być addytywne, łączone lub synergistyczne. Pełnią one wiele funkcji które nakładają się lub przeciwdziałają sobie. W konsekwencji funkcja wielu cytokin może się zmieniać w przebiegu odpowiedzi zapalnej (5). Reaktywne, toksyczne produkty tlenowe i azotowe interferują z ważnymi funkcjami biochemicznymi drobnoustrojów i komórek gospodarza. Prowadzi to do uszkodzenia błon komórkowych, utraty energii z magazynów komórkowych, zaburzenia integralności błon mitochondrialnych, a następnie do uszkodzenia nukleotydów (4, 7).
KLASYFIKACJA ZAPALEŃ BŁONY NACZYNIOWEJ.
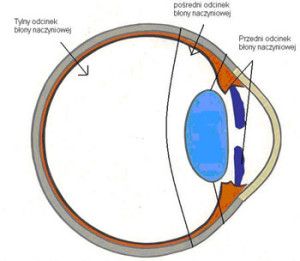
Ryc. 1. Klasyfikacja anatomiczna błony naczyniowej
Zapalenie w obrębie błony naczyniowej gałki ocznej nazywane jest zapaleniem błony naczyniowej (uveitis), z łaciny uvea, co oznacza grono. Klasyfikacja zapalenia błony naczyniowej opiera się na podstawie zmian anatomicznych, obrazu klinicznego oraz etiologii (2,3, 8). Na podstawie zmian anatomicznych wyróżniamy; zapalenie odcinka przedniego, zapalenie części pośredniej, zapalenie odcinka tylnego oraz zapalenie całej błony naczyniowej (ryc.1). Zapalenie ograniczone do przedniej komory oka określane jest jako zapalenie tęczówki (iritis), jeżeli rozprzestrzenia się ono do przestrzeni pozasoczewkowej, nazywane jest zapaleniem tęczówki i ciała rzęskowego (iridocyclitis). Zapalenie skoncentrowane w okolicy przedniej ciała szklistego i podstawy ciała szklistego, otaczającej ciało rzęskowe i obwodową część siatkówki to zapalenie części pośredniej błony naczyniowej. Gdy obejmuje siatkówkę i naczyniówkę (chorioretinitis) to mamy do czynienia z zapaleniem tylnego odcinka błony naczyniowej. Przylegające do błony naczyniowej ciało szkliste może też być zajęte procesem zapalnym. W przypadku, gdy zapalenie dotyczy całego wnętrza oka, mówimy wówczas o zapaleniu całej błony naczyniowej (panuveitis, 3, 8). Ze względu na początek i czas trwania zapalenie błony naczyniowej może być podzielone na ostre i przewlekłe. Epizody o nagłym i gwałtownym przebiegu określane są jako ostre formy zapalenia, natomiast łagodne i długotrwałe nazywane są formą przewlekłą (3). Dodatkowo proces zapalny może występować w jednym lub w obu oczach (8). W przewlekłym zapaleniu błony naczyniowej wyróżniamy formę ziarninującą i nieziarninującą. Nacieki w zapaleniu nieziarninującym zawierają limfocyty i komórki plazmatyczne zaś w zapaleniu ziarninującym także komórki nabłonkowe i olbrzymie (2, 8).
PRZYCZYNY ZAPALENIA BŁONY NACZYNIOWEJ.
Najczęstsze przyczyny zapaleń błony naczyniowej oka to; towarzyszące chorobom układowym, infekcje, inwazje pasożytnicze, inwazje pierwotniakowe, urazy mechaniczne, nowotwory, czynniki immunologiczne. Często ustalenie etiologii zapalenia jest niemożliwe, wówczas takie zapalenie błony naczyniowej określane jest jako zapalenie idiopatyczne. Wśród czynników powodujących zapalenie błony naczyniowej wyróżniamy; czynniki zewnątrzpochodne, gdy zapalenie spowodowane jest urazem zewnętrznym lub mikroorganizmami pochodzącymi z zewnątrz oraz czynniki wewnątrzpochodne, pochodzące od chorego organizmu. Przyczyny zapaleń błony naczyniowej możemy podzielić na czynniki natury infekcyjnej i nie-infekcyjnej (9, 10, 11, 12, 13, 14, 15, 16, 17; patrz tab. 1 i tab. 2).
TAB. 1. CZYNNIKI INFEKCYJNE JAKO PRZYCZYNY ZAPALENIA BŁONY NACZYNIOWEJ
TAB. 1. CZYNNIKI NIE-INFEKCYJNE JAKO PRZYCZYNY ZAPALENIA BŁONY NACZYNIOWEJ
OBJAWY KLINICZNE ZAPALENIA BŁONY NACZYNIOWEJ.
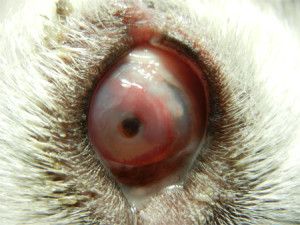
Ryc. 2. Hyphaema -wylew krwi do przedniej komory oka. Przyczyną tego zapalenia błony naczyniowej był uraz. (Zdjęcie dzięki uprzejmości dr David Gould)
Najczęstszymi objawami zapalenia przedniego odcinka błony naczyniowej jest reakcja obejmująca ból, zaczerwienienie, światłowstręt, zwężenie źrenicy, zmętnienie cieczy wodnistej oraz obniżone ciśnienie wewnątrzoczne (2, 3, 9). W większości przypadków na śródbłonku rogówki występują osady rogówkowe i włóknik. Zaburzenie czynności śródbłonka rogówki prowadzi do ostrego jej obrzęku. Przednia komora wykazuje intensywną odpowiedź komórkową i przymglenie cieczy wodnistej. W ciężkich przypadkach powstaje skrzep lub wysięk ropny (hypopyon). W miarę wzrostu przepuszczalności naczyń włosowatych ciecz wodnista w komorze przedniej ma charakter; surowiczy (przymglenie w tym przypadku spowodowane jest napływem białek), ropny (gdy dołączą się komórki wielojądrowe i resztki martwicze), włóknikowy albo krwisty (komórki zapalne z erytrocytami – hyphaema); ryc. 2.
Ryc. 3. Przewlekłe zapalenie błony naczyniowej. Widoczne osady rogówkowe i włóknik. Przyczyną tego uveitis było białko uwolnione z soczewki. (Zdjęcie dzięki uprzejmości dr David Gould)
Nasilenie reakcji zapalnej w przedniej komorze oka określane jest liczbą komórek zapalnych widocznych w szczelinie biomikroskopu o wymiarach 1 x 3 mm. Przyjęto skalę od 0 do 4+. Zero, oznacza brak komórek zapalnych, a 4+ komórki bardzo liczne, niepoliczalne (8). Osady rogówkowe są skupiskami komórek zapalnych na śródbłonku rogówki. Ich wygląd i rozmieszczenie może świadczyć o domniemanym typie zapalenia. Osady najczęściej powstają w środkowej i dolnej części rogówki zgodnie z ruchami konwekcyjnymi płynu w komorze przedniej oka (ryc.3).
Nowo utworzone osady są zwykle białawe, okrągłe i o gładkich brzegach. W miarę trwania procesu zapalnego stają się szkliste, ulegają pigmentacji i się kurczą. Duże żółtawe osady określane są jako sadłowate (mutton-fat) i towarzyszą zwykle zapaleniom ziarninującym (2, 3). Zajęcie procesem chorobowym tęczówki powoduje powstanie zrostów przednich – z rogówką (ryc.4) lub tylnych – z torebką soczewki. Zrosty tylne, rozciągające się wokół brzegu źrenicy uniemożliwiają przepływ cieczy wodnistej z komory tylnej do przedniej, powodują uwypuklenie obwodowej części tęczówki (iris bombe; ryc.5). Prowadzi to wtórnie do zamknięcia kąta przesączania (8). Na tęczówce powstają guzki, ziarniniaki, przebarwienia. Stopniowo dochodzi do zaniku zrębu tęczówki (ryc.6).
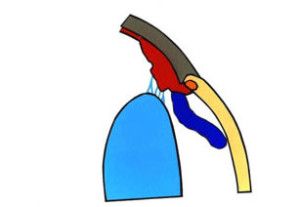
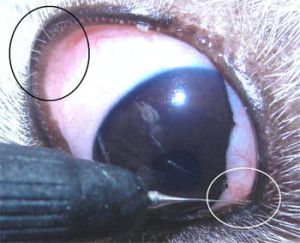
Ryc. 4. Zrost przedni. Tęczówka przyrasta do rogówki.
Ryc. 5. Zrost tylny. Tęczówka przyrasta do soczewki.
Krążące fragmenty włóknika osadzają się na powierzchni soczewki, a w skutek zaburzonego krążenia zapalnie zmienionej cieczy wodnistej, soczewka zmienia swój metabolizm. Prowadzi to do rozwoju katarakty (cataracta complicata; 2, 9). Skurcz mięśnia zwieracza źrenicy powoduje silne zwężenie źrenicy. Gdy proces zapalny obejmuje ciało rzęskowe i beleczkowanie, spada produkcja cieczy wodnistej, a tym samym obniża się ciśnienie wewnątrzoczne (9). W przypadku, gdy beleczkowanie zostanie przez komórki i resztki zapalne zaczopowane, ciśnienie wewnątrzgałkowe wzrośnie, powodując rozwój jaskry (2, 3, 8). Typowym objawem zapalenia przedniego odcinka błony naczyniowej jest okołorąbkowe poszerzenie naczyń (nastrzyknięcia rzęskowe), rozlane przekrwienie spojówki i nadtwardówki (10) (ryc.7).
Ryc. 6. Widoczne zrosty tylne, uwypuklenia tęczówki (iris bombe) oraz przebarwienia tęczówki. Przyczyną był chłonniak. (Zdjęcie dzięki uprzejmości dr David Gould)
Ryc. 7. Zapalenie całej błony naczyniowej. Widoczne okołorąbkowe poszerzenie naczyń krwionośnych, rozlane przekrwienie spojówki oraz obrzęk rogówki. Przyczyną zapalenia był nowotwór gałki ocznej. (Zdjęcie dzięki uprzejmości dr David Gould)
Wynikiem skurczu mięśnia rzęskowego jest silny ból, który może promieniować na obszar zaopatrywany przez trójdzielny nerw czaszkowy. Zwykle obserwuje się światłowstręt i wzmożone łzawienie (9). W zapaleniu pośredniej części błony naczyniowej, obserwuje się w ciele szklistym, agregaty komórek zapalnych tzw. „kule śnieżne”, które łączą się ze sobą tworząc „bałwany”. „Bałwany” mogą osiadać w dolnej części oka tworząc struktury nazywane „zaspami śniegu”. Często w tej postaci występuje zapalenie żył siatkówki, z pochewkami wokół żył w dolnej części siatkówki. Niedokrwienia związane z zapaleniem żył siatkówki w połączeniu ze stymulacją angiogenezy prowadzą do neowaskularyzacji w okolicy „zasp śnieżnych”. Naczynia te łatwo krwawią, przez co często powstaje odwarstwienie siatkówki (3, 8). W zapaleniu tylnego odcinka błony naczyniowej, badaniem okulistycznym stwierdza się; ogniskowe, wieloogniskowe lub rozlane obszary zapalenia siatkówki bądź naczyniówki. Ze względu na podobny obraz kliniczny zmiany te trudno zróżnicować. Zapalenie tylnego odcinka błony naczyniowej ma zwykle charakter przewlekły, nie towarzyszą mu ostre objawy chorobowe i zwykle pozostaje niezauważone przez właściciela (2, 9, 10).
POSTĘPOWANIE DIAGNOSTYCZNE I LECZENIE.
W identyfikacji zapalenia błony naczyniowej pomaga szczegółowy wywiad i rozpoznanie objawów chorobowych ze strony innych układów. Po przeprowadzeniu wszechstronnego badania fizykalnego, dalsza diagnostyka zapalenia wymaga badań laboratoryjnych. Podstawą wyboru badań powinna być najbardziej prawdopodobna przyczyna zapalenia. Zaleca się wykonanie badań podstawowych, obejmujących morfologię krwi ze wzorem odsetkowym, OB., profil biochemiczny, badania serologiczne np. w kierunku toksoplazmy, toksokarozy. W przypadku podejrzenia ehrlichiozy, leishmaniozy, nowotworów pomocne w diagnostyce będzie określenie poziomu globulin. W ocenie pewnych typów zapalenia błony naczyniowej konieczne jest wykonanie ultrasonografii, radiografii oraz biopsji ciała szklistego. W niektórych przypadkach, w celu ustalenia przyczyny choroby, pobrany materiał powinien być oceniany metodą PCR (3, 4, 9, 10, 11, 14).
Głównym celem terapii zapaleń błony naczyniowej jest zapobieganie powikłaniom zagrażającym widzeniu, zmniejszenie dolegliwości i leczenie, o ile jest to możliwe, choroby głównej. W leczeniu stosuje się kilka grup leków. Są to mydriatryki, steroidy, niesterydowe leki przeciwzapalne oraz leki immunosupresyjne (2, 3, 8, 10). Zapalenie błony naczyniowej na tle zakaźnym zawsze powinno być leczone odpowiednimi środkami przeciwbakteryjnymi lub przeciwirusowymi (11,12, 13, 14). Miejscowe leki mydriatyczne stosowane są w celu zmniejszenia bólu oraz w zapobieganiu lub przerywaniu tworzenia się zrostów tylnych. Zniesienie skurczu mięśnia rzęskowego i zwieracza źrenicy zapewnia psu komfort.
Im silniejsza reakcja zapalna, tym silniejszy lub częściej stosowany powinien być lek. Możemy używać krople krótko działające tj. tropikamid (0,5 lub 1% – okres działania 6 godzin), cyklopentolat (0,5 i 1% – okres działania 24 godziny), fenylefryna (2,5 i 10%). Fenylefryna ma 3 godzinny okres działania, lecz nie powoduje porażenia akomodacji (8). Mydriatykiem o długim okresie działania jest 1% atropina, z okresem działania nawet do 2 tygodni (3, 9). Podstawą leczenia zapalenia błony naczyniowej są kortykosteroidy. Wiążą one wewnątrzkomórkowe receptory, które przemieszczają się do jądra komórkowego, gdzie lek oddziałuje na transkrypcję DNA w mRNA. Kortykosterydy podawane miejscowo, hamują zapalenie poprzez wiele mechanizmów komórkowych. Steroidy mogą być stosowane; miejscowo, w postaci iniekcji lub też ogólnie. Miejscowo stosujemy je tylko w zapaleniu przedniego odcinka błony naczyniowej, ponieważ nie osiągają one stężenia terapeutycznego
w tkankach poza soczewką. Powinno się stosować preparaty silnie działające tj. deksametazon, betametazon, prednizolon w postaci roztworów, które lepiej penetrują przez rogówkę niż maści (2, 8, 9). Częstotliwość podawania kropli zależy od ciężkości procesu zapalnego. W przypadku, gdy efekt leczniczy wymagany jest w zakresie pośredniego i tylnego odcinka błony naczyniowej lub właściciel psa ma problem z zakraplaniem leku, wykonuje się iniekcje okołogałkowe. Długotrwały efekt leczniczy można uzyskać przez stosowanie preparatów w formie depot, np. triamcynolon, metyloprednizolon. Iniekcje można powtarzać co 2, 3 tygodnie (9,10). W przewlekłym zapaleniu błony naczyniowej lub w przypadku, gdy leczenia wymaga także choroba ogólna, kortykosteroidy stosuje się ogólnie. Głównym przedstawicielem tej grupy leków jest prednizolon. Stosuje się go w dawce od 0,5 do 1 mg/kg masy ciała w zależności od tego, jaki efekt chcemy uzyskać; przeciwzapalny czy immuosupresyjny (9, 18). W przypadku, gdy odpowiedź na leczenie kortykosterydami jest nieadekwatna lub istnieją przeciwwskazania do leczenia nimi np. ze względu na istniejące infekcje lub uszkodzenia rogówki, należy rozważyć zastosowanie niesterydowych leków przeciwzapalnych. Leki te poprzez wpływ na cyklooksygenazę hamują wytwarzanie prostaglandyn. Mogą być podawane miejscowo w postaci kropli do oczu np. naclof i difadol 0,1% lub podawane ogólnie w formie iniekcji lub tabletek np.karprofen (10). Innymi lekami, które modulują układ immunologiczny są leki immunosupresyjne.
Istnieje kilka klas tych leków. Obejmują one antymetabolity (azatiopryna), środki alkilujące (cyklofosfamid) i inhibitory komórek T (cyklosporyna, takrolimus). Wskazaniem do ich stosowania są przewlekłe, niespowodowane zakażeniem zapalenia błony naczyniowej, nie reagujące na konwencjonalną terapię sterydami oraz zapalenia błony naczyniowej tła immunologicznego np. choroba psów podobna do Zespołu Vogta-Koyanagiego-Harady u ludzi (15, 18). W przypadku opornego zapalenia błony naczyniowej, które nie odpowiada na leczenie zachowawcze, korzystne może być wykonanie witrektomii lub wszczepienie implantów zawierających kortykosteroidy czy też leki immunosupresyjne. Implanty takie powoli uwalniają lek nawet przez kilka lat po wszczepieniu (8).
PIŚMIENNICTWO
- Kobryń H., Kobryńczuk F.: Anatomia zwierząt, tom 3. Wydawnictwo Naukowe PWN, Warszawa 2004.
- Blouin P.: Uveitis in the dog and cat: couses, diagnosis and treatment. Can. Vet. J. 1984, 25, 315 – 323.
- Zagórski Z.: Zapalenia wewnątrzgałkowe i błony naczyniowej. Basic and Clinical Science Course, część 9. Wydawnictwo Medyczne Urban and Partners, 1 wyd., Wrocław 2005.
- Roitt I., Brostoff J., Male D.: Immunology. Gower Medical Publishing Londyn, Nowy Jork 1985.
- Davidson A., Diamond B.: Autoimmune diseases. N. Engl. J. Med. 2001, 345, 340 – 350.
- Walport M. T.: Advances in Immunology: complement – first of two parts. N. Engl. J. Med. 2001, 344, 1058 – 1060.
- Rao N. A.: Role of oxygen free radicals in retinal damage with experimental uveitis. Trans. Am. Ophtalmol. Soc. 1990, 8, 797 – 850.
- Kański J. J.: Okulistyka kliniczna. Górnicki Wydawnictwo Medyczne, 2 wyd., Wrocław 2005.
- Gould D.: The Eye. Rozdział 16. Manual of Canine and Feline Infectious Diseases. BSAVA, London 2004.
- Gilger B. C.: Clinical Syndroms in Canine and feline Uveitis. Waltham-OSU Symposium. 2001. Materiały pozyskane z internetu, http://www.vin.com.
- Brito F. L., Alves L. C., Ortiz J.P.D.,Maia F. C. L., da Silva V. A., Laus J. L.: Uveitis associated to the infection by leishmania chagasi in dog from the Olinda city, Pernambuco, Brazil. Ciencia Rural. 2004, 34, 3, 924 – 929.
- Wanke M. M.: Canine brucellosis. Anim. Reprod. Sci. 2004, 82-83, 195 – 207.
- Leiva M., Naranjo C., Pena M. T.: Ocular signs of canine monocytic ehrlichiosis: a retrospective study in dogs from Barcelona, Spain. Vet. Ophtalmol. 2005, 8, 6, 387 – 393.
- Oria A. P., Pereira P. M., Laus J. L.: Uveitis in dogs infected with ehrlichia canis. Cinc. Rural. 2004, 34, 4, 77 – 81.
- Sigle K., McLellan G. J., Haynes J. S., Myers R. K., Betts D. M.: Unilateral uveitis in a dog with uveodermatologic syndrome. J. Am. Vet. Med. Ass. 2006, 228, 4, 543 – 548.
- Barnett K. C., Sansom J., Heinrich C.: Canine ophtalmology: an atlas and text. Sounders, Londyn 2002, 142 – 145.
- Hahn K. A.: Ocular tumors. Tumor tidbits. 2001, 2, 9. Materiał pozyskany z internetu http://www.zzcat.com.
- Stiles J.: Infectiuos disease and the eye. Vet. Clin. North. Am. 2000, 30, 971 – 1167.
dr n. wet. Przemysław K. Bryła
Przychodnia Weterynaryjna w Warszawie
MANAGEMENTS OF THE CORNEAL TRAUMA IN ANIMALS
SUMMARY:
Ocular injures are unfortunately a common occurrence in animals. Appropriate detection, diagnosis and treatment decision are needed in case of corneal trauma. Treatment will vary depending on the nature of the wound. In some situations soft contact lenses may promote healing, whereas corneal lacerations may need surgical repair. Surgical treatment involves suturing third eyelid or a conjunctiva flap over the surface of the cornea. Perforated corneal lesion will need corneo-conjunctiva transposition graft to repair corneal defects. Postoperative uveitis and pain should be treated by topical and systemic agents.
Key words: corneal trauma, perforation, corneal ulcer, surgical management
Słowa kluczowe: rany rogówki, szwy chirurgiczne, soczewki kontaktowe, przeszczepy spojówki, przeszczepy rogówki
Rogówka (cornea) stanowi najbardziej zewnętrzną warstwę gałki ocznej. Wielkość, kształt, gładkość powierzchni oraz jej przejrzystość decydują o prawidłowej funkcji optycznej oka (1), (Fot. 1.).
Fot. 1. Prawidłowa rogówka psa.
Rogówka narażona jest na różne typy urazów od powierzchownych otarć do głębokich, penetrujących ran. Pewną ilość urazów stanowią ciała obce, oparzenia termiczne oraz uszkodzenia związane z działaniem kwasów i zasad (2, 3).
Lekarz przy pierwszym kontakcie z pacjentem musi zebrać niezwykle istotny wywiad o okolicznościach, czasie i miejscu powstania urazu. Ułatwia to postawienie diagnozy. Ustalić trzeba rozmiar rany, jej głębokość, uszkodzenia poszczególnych tkanek. Wstępna ocena obejmuje badanie lampą szczelinową, która daje odpowiedź na temat głębokości urazu (powierzchowny, sięgający w głąb istoty właściwej lub przeszywający), jej charakteru (otarcie, rana kłuta, szarpana), przebiegu (rana spojówki, rogówki, twardówki lub łączona), (4).
W wielu przypadkach urazów okulistycznych dochodzi do powstania przepuklin tkanek głębiej położonych i wciągnięcia ich w ranę rogówki. W takich sytuacjach bardzo pomocne mogą być dodatkowe badania w postaci USG o wysokiej częstotliwości lub UBM (ultrabiomikroskopia) czy tomografii komputerowej, umożliwiające ocenę np. torebki soczewki, tęczówki, ciała rzęskowego a także rozwarstwień rogówki (2,3).
W urazach rogówki istotne jest dokładne wybarwienie jej fluoresceiną, aby przekonać się o głębokości rany i stwierdzić w tak zwanym teście Seidla czy rana nie ma charakteru penetrującego do przedniej komory oka (2), (Fot. 2.).
Fot. 2. Powierzchnia rogówki wybarwiona fluoresceiną.
Urazy przeszywające rogówkę w zależności od rodzaju potrafią mieć różny charakter. Jeżeli powstały w wyniku działania ostrego cienkiego przedmiotu mogą uszczelnić się samoistnie i zatrzymać wyciek cieczy wodnistej. Zdarza się, iż w szczelinę rany wciągnięta może być tęczówka (częste po urazach zadanych kocim pazurem). Rany tego typu zawsze wymagają interwencji chirurgicznej, odprowadzenia tkanek zdrowych, usunięcia zanieczyszczonych i zniszczonych tkanek oraz zaszycia rany. W takich przypadkach konieczne może być odtworzenie komory przedniej oka z użyciem pęcherzyka powietrza, buforowanej soli fizjologicznej lub kwasu hialuronowego (2, 3).
Urazy powierzchowne, których objawem jest ubytek nabłonka przedniego rogówki są stosunkowo łatwe do leczenia i wymagają z reguły jedynie terapii zachowawczej. Przy uszkodzeniach bardzo płytkich preparaty nawilżające zawierające kwas hialuronowy w stężeniu powyżej 2 mg/ml i preparaty z dexpanthenolem oraz miejscowa antybiotykoterapia umożliwiają szybką odbudowę nabłonka rogówki (2, własne obserwacje autorów).
Rany sięgające w głąb stromy leczy się zachowawczo z użyciem antybiotyków i niesterydowych leków przeciwzapalnych podawanych ogólnie i miejscowo. Proces gojenia w takich przypadkach przyśpiesza
Fot. 3. Opatrunek z trzeciej powieki.
założenie opatrunku z III powieki (Fot. 3.), pełna lub częściowa tarsorafia , czy też użycie miękkich szkieł kontaktowych ( 5, 6).
Płaty wykonane z III powieki są powszechnie stosowane u zwierząt w leczeniu ran i owrzodzeń rogówki. Technika ta ma swoje zalety i wady. Zaletą jest łatwość jej wykonania, a taki płat zapobiega wysychaniu i drażnieniu uszkodzonej rogówki. Wadą tej metody jest brak wglądu w procesy gojenia się rany oraz to, że leki podawane na III powiekę w nikłym stopniu przenikają do rogówki. W takich przypadkach należy zastosować preparaty podawane ogólnie, które wraz z krwią dotrą do uszkodzonej rogówki (6). W porównaniu z powyższą metodą tymczasowe boczne zespolenie powiek (tarsorafia) , (Fot. 4.) jest zabiegiem prostym, zapewnia dobrą ochronę rogówce, a leki podawane miejscowo przez szparę powiekową łatwo penetrują do rogówki. Po lekkim rozchyleniu powiek w prosty sposób możemy kontrolować postęp w gojeniu się ran, wrzodów rogówki (5).
Cięższe przypadki uszkodzenia rogówki wymagają opracowania rany, usunięcia martwych tkanek i założenia opatrunku z trzeciej powieki lub ochronnego szkła kontaktowego stanowiącego swoistą komfortową ochronę (3, 5, 7). Zastosowanie soczewek terapeutycznych stało się standardem postępowania okulistycznego w leczeniu stanów patologicznych odcinka przedniego oka (Fot. 5.).
Fot. 4. Tarsorafia.
Soczewka w takich przypadkach pokrywając patologicznie zmienioną rogówkę działa jako opatrunek; zmniejszając ból, światłowstręt, nadmierne łzawienie. Pod taką soczewką nasilają się procesy regeneracyjne nabłonka i głębszych warstw zrębu, pobudza metabolizm rogówki, zwiększa przyleganie nabłonka. Zapewnia to równomierne uwodnienie rogówki, zmniejsza się kumulacja kolagenazy i redukuje obrzęk rogówki. Prawidłowo zastosowana miękka soczewka kontaktowa ochrania regenerujący się nabłonek rogówki przed ruchami powiek i nadkażeniem bakteryjnym (7). Zależnie od wskazań, wszystkie grupy leków okulistycznych mogą być podawane do oka z soczewką. Soczewki terapeutyczne można impregnować przez umieszczenie ich w płynie o odpowiednim stężeniu lub zakraplać leki do worka spojówkowego bądź na powierzchnię soczewki (7). Zwykłe soczewki kontaktowe hydrożelowe mogą być zaadoptowane jako soczewki terapeutyczne (7). Istnieją też przeciwwskazania do stosowania soczewek terapeutycznych np. ostre, czynne procesy infekcyjne odcinka przedniego oka, zaawansowane postacie suchego zapalenia spojówkowo-twardówkowego, ostre schorzenia ogólnoustrojowe, pogorszenie stanu oka po założeniu soczewki (7).
Fot.5. Soczewka kontaktowa Night and Day nałożona na rogówkę. Dla uwidocznienia soczewki terapeutycznej umieszczono pęcherzyk powietrza pomiędzy rogówką a soczewką. Dla stabilizacji soczewki należy założyć szew zbliżający powieki w 1/3 ich długości (obserwacje autora).
U pacjentów z niewielką pełnościenną raną rogówki często nie jest konieczne zakładanie szwów, wystarczy zastosować kleje tkankowe (3). Po raz pierwszy w okulistyce zastosowano je w roku 1968 (8). Obecnie wykorzystuje się je również w leczeniu schorzeń przedniego odcinka oka między innymi przy ścieńczeniach, owrzodzeniach i perforacjach rogówki. Kleje te dobrze sprawdzają się, jeżeli ubytek ma mniejszą średnicę niż 3 mm. Jednak ze względu na toksyczność pochodnych cyjanoakrylowych, niezwykle istotna jest precyzyjna technika aplikacji kleju (8). Nowością są próby wykorzystania pochodnych polisacharydowych do zaopatrywania ran rogówki. Związki te nie wykazują toksyczności w stosunku do śródbłonka rogówki (9).
W medycynie weterynaryjnej przyjęło się zakładanie na rany rogówki szwów. Do tego celu używa się nici o rozmiarze 8-0, 9-0 oraz 10-0. Zwykle są to nici vicrylowe z igłą atraumatyczną o kształcie szpatuły. Technika szycia polega na zakładaniu szwów pojedynczych lub ciągłych (5, 6). Istnieją dwie koncepcje co do głębokości zakładania szwów rogówkowych. Koncepcja klasyczna – do 90% głębokości rogówki, tak aby nie uszkodzić błony postawnej. Ma to stanowić zabezpieczenie przed wtórnymi infekcjami spowodowanymi wnikaniem drobnoustrojów kanałem nici, oraz ma zapobiegać wrastaniu nabłonka i uszkodzeniom śródbłonka (3, 5). W medycynie ludzkiej szwy zazwyczaj zakładane są przez całą głębokość rogówki. W tej koncepcji nie zauważa się zwiększonej liczby powikłań, a stosowanie szwów przez całą grubość ma plusy w postaci pewniejszego i mocnego zbliżenia brzegów rany, dokładnego ułożenia śródbłonka co przyspiesza gojenie i zmniejsza rozmiar blizny pooperacyjnej (3). W przypadku ran rozległych o nieregularnych brzegach, uniemożliwiających bezpośrednie zbliżenie, zastosować można uszypułowany przeszczep spojówkowy (5, 6), (Fot. 6)
Przeszczepy te mechanicznie wzmacniają rogówkę, zapewniają ciągłą dostawę surowicy, która zawiera antykolagenazy i czynniki wzrostu. Krew jest źródłem aktywnie dzielących się fibroblastów a zarazem dostarcza podane ogólnie leki bezpośrednio do miejsca
Fot. 6. Płat spojówkowy naszyty na dużą ranę rogówki. Widoczne naczynia krwionośne spojówki. Stan na 7 dni po zabiegu.
uszkodzenia (5). Wyróżnia się kilka rodzajów przeszczepów spojówkowych: wyspowy, całkowity kapturowy, mostkowy czy też przeszczep rotowany (6). Wykonanie takich przeszczepów jest pracochłonne i wymaga wprawy operatora. Wykonuje się je pod mikroskopem. W przypadku, gdy mamy do czynienia z pęknięciem rogówki (pełnościenna rana ściany gałki ocznej) wówczas możemy wykonać przeszczep uszypułowanego płata spojówki tzw. odwrócony. W przeszczepie tym powierzchnia gałkowa spojówki skierowana jest w stronę komory przedniej oka. Celem takiego działania jest uniknięcie napływu krwi do komory przedniej oka (5). Uszypułowane płaty spojówkowe po kilku tygodniach odcina się od naczyń krwionośnych, które je zaopatrują. W ten sposób płat ten stopniowo zanika, a rogówka w tym miejscu staje się przejrzysta. Zwykle taki proces trwa kilka miesięcy ( doświadczenia własne autorów).
Przy ranach lub owrzodzeniach rogówki sięgających do błony Descemeta (Fot. 7) dobrym rozwiązaniem jest zastosowanie tzw. przesuniętego wyizolowanego płata rogówkowo-spojówkowego i naszycie go na oczyszczoną ranę rogówki. Płat taki pozyskuje się z rogówki bezpośrednio z okolicy rany. Za pomocą specjalnego noża w kształcie lamelarnym, rozwarstwia się rogówkę w ½ jej grubości, aż do rąbka i spojówki gałkowej. Tak uwolniony płat pozwala pokryć ubytek w rogówce. Płat ten łączy się z rogówką szwami 8-0. Po kilku tygodniach rana wygaja się (6).
Bardzo trudno jest leczyć duże ubytki w rogówce, tam gdzie mamy urazy pełnościenne. Można próbować leczyć je za pomocą przeszczepów rogówkowych (w weterynarii problematyczne) lub keratoprotez (1).
Fot. 7. Przepuklina Descemeta.
Keratoprotezy są nowoczesną metodą pozbawioną wad naturalnego przeszczepu posiadającą doskonałe właściwości optyczne. Wykonane są głównie z silikonu, co powoduje dobrą tolerancję immunologiczną, ale niestety mają krótki okres przeżywalności i również nie sprawdziły się w okulistyce weterynaryjnej ( 10).
Wielu urazom rogówki towarzyszy obecność ciał obcych wewnątrz gałki ocznej. Właściwa ocena ich charakteru i położenia umożliwia podjęcie właściwej decyzji o metodzie usunięcia (pomocne są badania dodatkowe takie jak RTG, USG, CT). Jest to bardzo istotne, ponieważ niewłaściwe postępowanie przyczynia się do powstania wtórnych uszkodzeń rogówki oraz innych części gałki ocznej. Nie zawsze usunięcie ciała obcego przez ranę wlotową jest możliwe lub celowe. Przejrzystość rogówki uzyskana bezpośrednio po zabiegach z reguły jest niezadowalająca. Utrzymuje się obrzęk, często następuje wrastanie naczyń krwionośnych. Procesy te z czasem wycofują się poprawiając wygląd i zdolność widzenia zwierzęcia. Do przyspieszenia regeneracji używa się preparatów z kwasem hialuronowym, panthenolem, glicerolem, witaminą B12 oraz stężoną solą fizjologiczną (2, 3, 5, 6 oraz obserwacje własne autorów).
PIŚMIENNICTWO :
- Bryła P. K.: Keratoplastyka czyli przeszczep rogówki. E-kwartalnik Okulistyka Weterynaryjna, 2011,1,art. 03.
- Balicki I., Trbolowa A.: Rany rogówki – rozpoznawanie i leczenie. Medycyna Weterynaryjna, 2006, 06, 11-15.
- Kopacz D., Maciejewicz P., Kotela-Węgrzyn K., Kalińska J., Kęcik D.: Zaopatrzenie ran rogówki-zasady postępowania. Okulistyka 2010, 4 (Rok XIII), 19-22.
- Rejdak R., Stopa P., Chorągiewicz T., et al. : Urazy gałki ocznej- nazewnictwo, klasyfikacja i rokowanie. Okulistyka 2010, 4 (ROK XIII), 9-12.
- Mags D. J.: Rogówka i twardówka. Edytowana Mags D. J., P. E. Miller, R. Ofri. W: Okulistyka weterynaryjna Slattera. Elsevier Urban and Partner, Wrocław 2009, s 204 – 207.
- Gilger B. C., Olivier E. J., Bentley E.: Diseases and surgery of the canine cornea and sclera. Edytowana K. N. Gelatt. W: Essentials of Veterinary Ophthalmology. Wiley Blackwell 2008, II wyd. USA, s. 119-145.
- Bełżecka A.: Terapeutyczne zastosowanie soczewek kontaktowych. Academy for eye care excellence. Ciba Vision.
- Kubicz A., Szalińska M., Misiuk-Hojło M.: Cyjanoakrylowe kleje tkankowe w leczeniu schorzeń przedniego odcinka gałki ocznej. Katedra i Klinika Okulistyki Akademii Medycznej we Wrocławiu. E-mail: klinika@okulist.am.wroc.pl
- Bhatia S. K., Arturs S. D., Chanault H. K.: Polisacharyde based tissue adhesive for scaling corneal incision. Invest. Ophthalmol. Vis. Sci. 2005, 46, 4, 1247-1250.
- Allgoewer I., McLellan G. J., Agarwale S.: A keratoprosthesis prototype for the dog. Veterinary Ophthalmology 2010, 13, 47-52. Doi 10.1111/J.
Dr n. wet. Przemysław K. Bryła
Przychodnia weterynaryjna w Warszawie
TREATMENY OF DISTICHIASIS IN A DOG USING ELECTROLISIS
SUMMARY:
The eyelids represent a structure composed of skin and cutaneous appendages, including hair follicles and glandular structures. The eyelids and ocular adnexa comprise the primary surface defence for the globe, specifically the cornea. There are three main forms of ciliary disorders: distichiasis, trichiasis and ectopic cilia. The abnormally placed hairs irritate the cornea. The affected eye will become red, inflamed and may develop a discharge. In severe cases, the cornea may became ulcerated. Both upper and lower lids may be involved. Some breads are affected more, suggesting that it is an inherited trait. Ciliary abnormalities are extremely rare in the cat. The diagnosis is made by direct visualization, although head loupe or slit-lamp magnification is helpful. The abnormal eyelashes are best removed through the use of surgery, kryotherapy or electroepilation. This report documents bilateral distichiasis in west highland white terrier. The distichia were removed using electroepilation technique.
KEY WORDS :
dog eyelash, distichiasis, trichiasis, ectopic cilia, electroepilation
WPROWADZENIE
Powieki, są to ruchome fałdy skórno-mięśniowe, które pokrywają gałkę oczną. Gdy są zamknięte zakrywają oko, w czasie mrugania rozprowadzają łzy, dzięki czemu chronią je przed wysychaniem. Między powiekami znajduje się szpara powiekowa. Powieki łączą się ze sobą spoidłem bocznym i przyśrodkowym powiek, w ten sposób tworząc kąt oka boczny i przyśrodkowy (1). Na wolnych brzegach powiek wyróżniamy krawędzie (blaszki) przednie i tylne (1, 2). Krawędzie te oddzielone są od siebie linią szarą. Krawędź (blaszka) przednia, zbudowana jest ze skóry i mięśnia okrężnego oka, natomiast krawędź (blaszka) tylna składa się z tarczki oraz spojówki (3). Tarczka jest to płytka zbudowana z tkanki łącznej włóknistej, która nadaje powiece pewną sztywność (1, 3). W brzegu powieki znajdują się gruczoły: Meiboma, Molla i Zeisa (3, 4). Liczne gruczoły Meiboma zlokalizowane są w tarczce.
Są to zmodyfikowane gruczoły łojowe, które wydzielają zewnętrzną lipidową warstwę przedrogówkowego filmu łzowego. Otwierają się one

Fot. 1. Distichiasis. Nieliczne, cienkie rzęsy.
na brzegu powieki, tylnie od linii rzęs i widoczne są makroskopowo przez spojówkę powiekową. Rolą ich jest także zapobieganie przelewaniu się łez przez krawędź powieki (4). Na brzegu powiek, u podstawy rzęs, zlokalizowane są ujścia zmodyfikowanych gruczołów potowych. Gruczoły te nazywane są gruczołami Molla (3). Obecne są tu także szczątkowe gruczoły łojowe zwane gruczołami Zeissa. Gruczoły te otwierają się do mieszków włosowych, z których wyrastają rzęsy (1, 4). U psów rzęsy głównie występują na zewnętrznej powierzchni górnej powieki, rzadko na powiece dolnej, natomiast u kotów nie spotyka się typowych rzęs tylko zmodyfikowane włosy identyfikowane jako rzęsy (1, 4, 5).
Ruchy powiek zależne są od pracy szeregu mięśni (1). Wyróżniamy tu; mięsień okrężny oka, mięsień marszczący brwi, mięsień dźwigacz powieki górnej oraz mięsień obniżający powiekę dolną. Powieki zabezpieczają oko poprzez czuciowe i ochronne działanie rzęs. Nieprawidłowa budowa i funkcjonowania powiek i rzęs są często przyczyną wielu patologii w obrębie gałki ocznej, zwłaszcza u psów (4). Korzenie rzęs leżą w przestrzeni pomiędzy częścią przedtarczkową mięśnia okrężnego oka a mięśniem Riolana (3). Następnie przechodzą pomiędzy tymi mięśniami i wychodzą na powierzchnię skóry na przednim brzegu powieki. Wszystkie rzęsy wygięte są w kierunku przeciwnym w stosunku do powierzchni gałki ocznej i są ułożone względnie równolegle. Ponieważ nie posiadają mięśni przywłośnych, ich ułożenie oraz kierunek
Fot. 2. Distichiasis. Grube, sztywne rzęsy.
wzrostu uzależnione są od otaczającego mięśnia okrężnego i mięśnia Riolana oraz od tarczki. Jeżeli więc tarczka lub któryś z w/w mięśni są nieprawidłowe, to ułożenie i kierunek wzrostu rzęs mogą ulec zaburzeniu (3).
Nieprawidłowy wzrost rzęs (trichiasis) jest często nabytym schorzeniem, które może występować jako postać izolowana lub być wynikiem bliznowacenia brzegu powieki. Trichiasis należy różnicować z pseudotrichiasis, powstałym wtórnie do podwinięcia powiek. Tylne ukierunkowanie wzrostu rzęs, wyrastających z prawidłowych miejsc, prowadzi do punktowych uszkodzeń nabłonka rogówki, a w przypadkach długotrwałych może nawet doprowadzić do powstania owrzodzenia rogówki (3, 4). Oprócz tego typu patologii rzęs wyróżniamy jeszcze dwa rodzaje ich nieprawidłowości. Jedną z takich nieprawidłowości jest dwurzędowość rzęs (distychiasis) często spotykana u ras takich jak: pudel, maltańczyk, west highland white terrier czy też cocker spaniel, shih tzu. U tych ras psów choroba ma prawdopodobnie podłoże dziedziczne (4, 5), (Fot. 1).
W dwurzędowości rzęs pewna ich liczba wyrasta z gruczołów Meiboma. Nieliczne i miękkie rzęsy rzadko wywołują podrażnienia nabłonka rogówki, wobec czego nie mają klinicznego znaczenia. Natomiast liczne i twarde prowadzą do chronicznych uszkodzeń rogówki. W takich przypadkach wymagana jest interwencja chirurgiczna (3,4), (Fot. 2).
Kolejną nieprawidłowością rzęs są rzęsy ektopowe (ectopic cilia). Wyrastają one z gruczołów Meiboma, ale przebijają spojówkę powiekową, wywołując silne drażnienie rogówki, prowadzące do jej owrzodzenia. Bywa, że rzęsy te widoczne są jedynie w dobrym oświetleniu i przy użyciu szkieł powiększających. Znalezienie ich ułatwia też wybarwienie oka fluoresceiną (3, 4, 5). Nieprawidłowości rzęs mogą dotyczyć jednego lub obu oczu. W większym stopniu dotyczą powieki górnej niż dolnej. Zwykle obserwuje się je u osobników młodych (2, 4). Nieprawidłowości rzęs bardzo rzadko występują u kotów (5).
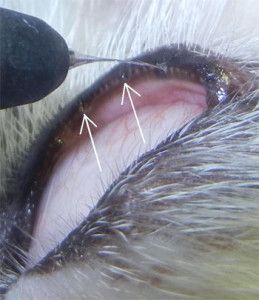
Fot. 3. Elektroepilacja. Strzałki pokazują miejsca po epilacji i usunięciu patologicznych rzęs.
OBJAWY KLINICZNE NIEPRAWIDŁOWOŚCI RZĘS
Nieprawidłowości rzęs wywołują szereg objawów klinicznych. Najpierw obserwowane jest nadmierne łzawienie, które powoduje powstanie przebarwienia włosów w okolicy oczu i bruzd twarzowych. Następnie pojawia się reakcja bólowa oka. Zwierzęta manifestują ją mrużeniem oczu, pocieraniem oka łapą lub ocieraniem okolicy oczu o przedmioty. Powierzchowne naczynia spojówek są wypełnione krwią, co powoduje przewlekłe ich przekrwienie. W postaci zaawansowanej dochodzi do uszkodzenia nabłonka rogówki, a następnie powstają owrzodzenie rogówki. Wrzody powodowane rzęsami są zwykle płytkie i często występują na obrzeżach rogówki. Za pomocą źródła światła oraz szkieł powiększających należy zlokalizować nieprawidłowe rzęsy i dopiero potem zadecydować o formie leczenia powstałego stanu patologicznego oka (2,3,4,5).
LECZENIE NIEPRAWIDŁOWOŚCI RZĘS
W leczeniu nieprawidłowości rzęs wykorzystywano i wykorzystuje się szereg metod i zabiegów. Część technik typu – rozdzielenie powieki zostało zaniechanych, ponieważ często dochodziło do szeregu powikłań ( bliznowacenie, podwinięcie powiek, zanik gruczołów), (3). Z kolei epilacja za pomocą szczypczyków ma krótkotrwałą skuteczność, gdyż już po 3-4 tygodniach dochodziło do odrastania rzęs (4). Obecnie przyjęto, że najbardziej użyteczną metodą jest kryoepilacja oraz elektroepilacja. Przy czym elektroepilacja (Fot. 3) stosowana jest w leczeniu niewielkiej liczby patologicznych rzęs, zaś krioterapia ma zastosowanie tam, gdzie występują liczne nieprawidłowe rzęsy (5, 6).
ELECTROEPILACJA
Do zabiegu elektroepilacji rzęs zakwalifikowano sześciomiesięcznego psa rasy west highland white teriera, u którego stwierdzono distichiasis powieki górnej i dolnej. Zabieg wykonano elektroepilatorem SkinMate model SM-8809 (Fot.4). Jest to jednostka kompaktowa, w której można w sposób płynny regulować natężenie prądu – zakres tej regulacji wynosi od 0 do 100 µA.
Fot. 4. Elektroepilator SkinMate.
Czas oddziaływania prądu reguluje się przyciskiem nożnym. Zwykle potrzebne jest ok. 10 – 20 sek. do uzyskania efektu epilacji rzęsy. Elektrodę, stanowi cienka stalowa igła o tępym zakończeniu, zamocowana do końcówki w kształcie długopisu. Zabieg epilacji polega na wprowadzeniu, pod odpowiednim powiększeniem (lupa oczna, mikroskop operacyjny), elektrody bezpośrednio do mieszka włosowego. Impuls elektryczny przepływający przez elektrodę powoduje koagulację białek, co trwale uszkadza macierz mieszka rzęsy. Makroskopowym wskaźnikiem udanej koagulacji jest pojawienie się białego pęcherzyka wokół rzęsy. Sama rzęsa wówczas łatwo daje się usunąć za pomocą pęsety lub też przywiera do elektrody z którą jest usuwana. Niskie natężenie użytego prądu zapobiega wystąpieniu skurczu mięśnia okrężnego oka i nie powoduje uszkodzeń tkanek otaczających rzęsy.
Na kilka dni przed zabiegiem do worka spojówkowego podawano 3 razy dziennie krople Tobrosopt 0,3% (WZF Polfa S. A.). Zabieg elektroepilacji wykonano w znieczuleniu ogólnym dysocjacyjnym z zastosowaniem Vetaketanu 100 mg/ml (Vetagro) po uprzedniej premedykacji Xylapanem 20 mg/ml (Vetoquinol). Worek spojówkowy bezpośrednio przed zabiegiem odkażono 0,5% jałowym roztworem povidone iodine. Po zabiegu epilacji jeszcze przez 7 dni zakraplano do worka spojówkowego Tobrosopt.
Kontrolę skuteczności zabiegu przeprowadzono osiem tygodni później. Niestety, okazało się, że niektóre rzęsy ponownie odrosły. Pozytywnym efektem elektroepilacji było to, że rzęsy te były cienkie i miękkie, w porównaniu do tych usuniętych zabiegiem epilacji.
PIŚMIENNICTWO:
- Kobryń k., Kobryńczuk F.: Anatomia zwierząt, t.3, WN PWN, Warszawa 2006, s.216-218.
- Akajewski A.: Anatomia zwierząt domowych, t. 2, wydanie polskie pod redakcją T. Rozkosza. PWRiL, Warszawa 1979, s. 418-419.
- Kański J. J.: Powieki. W: Okulistyka Kliniczna, drugie wydanie polskie, Wydawnictwo Górnicki, Wydawnictwo Medyczne, Wrocław 2005,s. 2-6.
- Maggs D. J.: Powieki. W: Okulistyka weterynaryjna Slattera. Wydana przez Maggs D. J., Miller P. E., Ofri R. Elsevier Urban & Partner, wydanie I polskie, Wrocław 2009, s 117-120.
- Reinstein S. L., Gross S. L., Komaromy M. Succesful treatment of distichiasis in cat using transconjunctival electrocautery. Veterinary Ophthalmology, 2011, 14, supp. 1, s 130-134.
- Kiełbowicz Z.: Treatment of irregularities in eyelash growth in dogs. Medycyna Wet. 2003, 59 (5), 429-431.
PRZEMYSLAW K. BRYLA
Veterinary Surgery, Warsaw
STRESZCZENIE
CO TO JEST SUCHE ZAPALENIE SPOJÓWEK I ROGÓWKI I JAK JE LECZYMY?
Suche zapalenie spojówek i rogówki u zwierząt (KCS) powstaje na skutek zubożonej produkcji łez, co skutkuje ich niedoborem. Choroba objawia się wysuszeniem powierzchni oka. Oko jest zaczerwienione, zwierzę odczuwa świąd. Pojawiają się na powierzchni rogówki keratopatie. Schorzenie występuje u psów, kotów a nawet koni. W miarę trwania choroby, wokół oczu na powierzchni powiek, odkłada się ropna wydzielina. Istnieje wiele przyczyn powodujących taki stan. Głównie są to zaburzenia natury immunologicznej, wady wrodzone, urazy, reakcje polekowe, infekcje wirusowe oraz zaburzenia hormonalne. Rozpoznanie choroby odbywa się za pomocą testu łzowego Schirmera (STT). Leczenie polega na podawaniu preparatów nawilżających oko oraz leków stymulujących produkcję łez (cyclosporyna A, tacrolimus). W przypadku, gdy leczenie takie nie przynosi oczekiwanych rezultatów, można zastosować zabieg transpozycji przewodu ślinianki.
SUMMARY
Keratoconjunctivitis sicca – KCS- “dry eye” is due to an aqueous tear deficiency. This results in persistent , mucopurulent conjunctivitis and corneal ulceration and scaring. KCS occurs in dogs, cats and horses. With time, some of the mucous can build up around the eye, becoming dry and crusty. As the conditions progresses, the cornea becomes invaded with blood vessels, scarred and pigmented. There are a number of possible causes i.e. autoimmune, congenital, trauma, drug reactions, viral infections and hormone imbalance. Dry eye is diagnosed with a Schirmer tear test. Therapy consists of artificial tear solutions, ointment and antibiotic combinations. Lacrimogenics such as topical cyclosporine A or tacrolimus may increase tear productions. In chronic KCS refractory to medical therapy, parotid duct transpostion is indicated.
KEY WORDS : KCS, Dry eye, Cyclosporine A, Tacrolimus, Parotid duct transposition
INTRODUCTION
Tears are essential to the comfort of the eyes. Without tears, eyes become irritated. An adequate supply of tears covering the partially exposed anterior segment of the globe and associated adnexa is necessary for optical integrity, maintenance of the cornea and normal eye function. This fluid is called the preocularl tear film PTF (1). Without tears (KCS) develops (2).
Anatomy of the lacrimal system
The lacrimal system consists of a secretory and an excretory component. These components are responsible for production and excretion of the tear film (3). The lacrimal system in animals consist of the orbital lacrimal gland and the third eyelid gland, which secretes tears. The orbital lacrimal glands lies over the upper, outer corner of the eye. Its excretory ducts branch downward toward the eyeball. A constant stream of tears washes of the eye and is drained off through two small openings located in the inner corner of the eyelids. Through these openings the tears pass into the lacrimal canaliculus, then through the lacrimal sac into the nasolacrimal duct and finaly into the nasal cavity (4). Some animals have an accessory opening in the canal as it pass by the root of the upper canine tooth (1).
Ryc.1. Lacrimal apparatus in dog.
Histologically, the gland is a mixed tubuloalveolar type. Its function is production of the serous portion of tears (1). Conective tissue, blood vessels and nerve fibers comprise the glandular stroma. Male lacrimal glands are larger than females once. The orbital lacrimal and third eyelid glands are innervated by sympathetic and parasympathetic nerve fibers and primary control is mainly exerted by the parasympathetic nervous system (4). Clinically, certain cholinergic drugs e.g. pilocarpine will stimulate tear secretion, whereas other drugs i.e. anticholinergics will decrease tear secretion (1). Tears are present over the surface of the eye as a triple-layered film. The outer, thin, superficial oily layer is provided by sebaceous gland of Zeis and the Meibomian glands. This layer reduces evaporation of the underlying aqueous tear and forms a barrier along the lid margins that prevents overflow onto the face (1). The intermediate or aqueous layers is secreted by the orbital gland (60%) and third eyelid glands (40%) and is the largest layer of the tear film, measuring approximately 7 µm. In addition to water, this layer contains electrolytes, glucose, urea, active surface polymers, glycoproteins and lacrimal proteins, including immunoglobuline A, albumin, beta-lysine, lysozyme and lactoferrin (4). The third, innermost layer is the mucin layer, which is produced by the conjunctival goblet cells. This mucin layer absorbed to the corneal epithelial surface and distributed evenly during normal blinking. The mucin provides a hydrophilic surface over which the aqueous tear fluid spreads evenly (1). The main function of the third layer is to correct corneal surface irregularities, in addition to promoting tear adhesion to the corneal epithelium (5).
Causes of the dry eye
There are many causes of KCS. Studies support that most cases of dry eye in dogs are the result of immunomediated disorders since affected animals frequently exhibit T- cell infiltration in the lacrimal glands (4). The immune system identifies the dog’s own tear glands as “foreign”, and attempts to destroy them. As a result, tear production is progressively reduced, and left untreated, can be lost all together. There is circumstantial evidence that the disease resembles Sjögren’s syndrome in human. This syndrome is a systemic autoimmune disease characterized by KCS, xerostomia and plasmacytic lymphoadenitis as also described in dogs (4, 6). Other sources of dry eye include drug toxicity. The sulfa drugs (Tribrisen) are notorious for causing KCS. The mechanism of action of sulfonamides in KCS is not completely understood, but it is believed to be a response of T cells to haptens generated by oxidative metabolites derived from these substances (7). Some dogs are born with defective tear glands (as described in certain lines of Yorkshire terrier), (2, 3). Also procedures performed under general anesthesia lasting longer than two hours can lead to a significant decrease in tear production (8). Removal of the third eyelid tear producing gland , instead of replacing the gland in its proper location during surgery for “Cherry eye” can lead to KCS (9). Likewise, damage to the facial nerve was found to be associated with iatrogenic KCS (1, 4). Recently, cyclophotocoagulation of the cilliary body with the laser for the treatment of glaucoma in dogs has been recognized as a potential cause of dry eye (4). KCS is thought to be by some viral infections like canine distemper . In cat dry eye has been associated with chronic feline herpesvirus-1 infection. In horses, KCS may follow head trauma (4). There is also thought to be a connection between metabolic disease like: hypothyroidism, hyperadrenocorticims and diabetes mellitus and KCS (10). Decreased lipid layer production is observed in older dogs and is due to abnormal secretion of the tarsal gland (4).
Clinical signs
The earliest symptoms of KCS is conjunctivitis, or inflammation of the inner eyelids. As the conditions develops, mucous threads may be noticed on the surface of the eye, which move as the dog blinks, or build up at the bottom of the eye, near the lower lid. It occurs when there is a deficiency in the water portion of the tear film which normally accounts for 95% of the tear volume (1). The condition progresses to keratitis, inflammation of the cornea. Dog will often show signs of discomfort, and corneal ulcers are frequently present at this stage (2). Certain signs are highly suggestive of dry eye including: red, irritated or bloodshot eyes, clouding or pigmentation of the cornea and reduced vision (11). Any dogs are affected by dry eye (KCS), but some breeds are predisposed. These include: Westies, Cocker Spaniels, Yorkshire Terriers, Jack Russel Terriers, Lhasa Apso, Labradors. Springer Spaniels, Shit Tzu, Bull Dogs, Collies. The conditions can occur at any age, but is most commonly seen in dogs of 6 to 10 year of age (2, 4, 11).
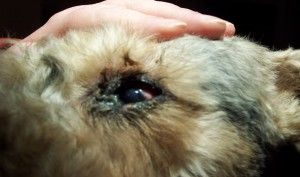
Phot.1. Keratoconjunctivitis sicca in Yorkshire Terrier.
Diagnosis
Keratoconjunctivitis sicca can be diagnosed by the Shirmer tear test (STT).
Phot. 2. Schirmer tear test – STT.
Two types of the STT have been described (STT-1 and STT-2). STT-1 measures basal and reflex tear production and is the most commonly used test. The STT-2 evaluates basal tear production after topical application of an anesthetic and of predictive values in animals with corneal ulceration which do not tolerate the STT-1 (2, 4). To perform the STT-1 test, a strip of special paper is inserted inside the lower eyelid in the outer corner of the eye for 60 seconds (12). The moisture of the eye will wet the paper. At the end of the 60 second period, the height of the moistened area is measured.
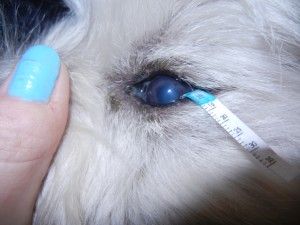
Phot.3. Measuring of STT-1.
A height of 15 mm or more is normal. A height 11 – 14 mm is a borderline results, but the less than 10 mm means the eye is dry. A height less than 5 mm the eye is severely dry (11).
In the STT-2 normal values are 4 – 5 mm/min (4, 12). Animals with dry eye condition should also be checked for the presence of corneal ulcers. This is achieved by performing the Fluorescein Stain Test (2). An alternative method for the estimation of tear production in dogs is the phenol-red-thread test. This test lasts only 15 seconds. Reference values for dogs ranges from 30 – 38 mm/15 seconds (5).
Qualitative tear film production is measured by the tear film breakup time (BUT). This time is evaluated by biomicroscopy using a cobalt blue filter after topical installation of fluorescein. The normal (BUT) time in dogs is 20 or more seconds. Less than 20 seconds are considered to indicate KCS (4).
Treatment of “Dry eye”
The successful therapy for KCS is the use of lacrimomimetics, lacrimostimulant medications and anti-inflammatory agents (2, 4). If the cause of the dry eye is known, than treatment should be aimed towards eliminating it (7). Unfortunately, in many cases, the cause of the KCS is never known (4). Most cases of dry eye are managed rather than cured. There are two types of long term medical treatment for dry eye; artificial tears, used to wet the eye, and drugs which stimulate tear productions. Treatment may include also topical antibiotics and clean the eye and keep them free of discharge, especially before applying medication (2). Artificial tears are slightly viscous drops or ointments that wet the eye. The problem with these is that they have to be applied to the eye very frequently. Typically this means every two hours or more frequently. There are a number of brands available in different formulations containing hypromellose, dextran, carboxymethylcellulose, chondroitin sulfate, and polyacrylic acid (2, 4, 11). A breakthrough came with the discovery of lacrimostimulants like cyclosporine A (13).

Phot.4. Optimmune produced by Intervet.
Other lacrimostimulants now know are : pimecrolimus, tacrolimus, diquafosol tetrasodium, cholinergic drugs (pilocarpine) and nerve growth factor NGF (4, 14, 15).
Cyclosporine are non-cytotoxic agents. It inhibits T-helper cell activity and shifts the regulations of the immune response towards immune tolerance (16). Topical cyclosporine has several beneficial effects in dry-eye patients. One of these effect is to increase secretion of physiologic tears. Physiologic tears, as opposed to the artificial tears, contain growth factors to regulate corneal-cell turnover and healing, lyzozyme and antibodies for infection control and numerous nutritional elements required for the health of the avascular cornea. Topical CsA appears to facilitate lymphocytic apoptosis and suppress epithelial-cell apoptosis, allowing regeneration of lacrimal gland. Cyclosporine also restores goblet-cell mucin production (13, 16). The majority of KCS dogs require lifelong CsA- treatment. Interruptions in therapy lead to relapse of KCS (16). Cat have a lower tolerance to this ocular irritation then do dogs (16). Recommended frequency is usually twice daily and can be adjusted more or less frequently to effect. Topical use of 0,2% CsA is safe and does not favor the occurrence of ocular infections (4).
Pimecrolimus is an ascomycin derivative which selectively interferes with the activation of T cell and mast cells, inhibiting the production of inflammatory cytokines. In veterinary ophthalmology topical application one drop, 3-times a day of a 1% solution was able to increase STT values in dogs with KCS and to reduce corneal inflammation with superficial keratitis. The superiority of pimecrolimus might be attributed to its low molecular weight compared to CsA (4).
Other lacrimostimulant used in KCS treatment is tacrolimus. This is macrolide antibiotics, which is 10 to 100 times more potent in vitro than CsA. A topical aqueous solution of 0,2% tacrolimus was found to be effective in increasing tear productions in dogs with dry-eye (4, 14).
Diquafosol tetrasodium is a new dinucleotide which functions as an agonist at the P2Y2 receptors and has been developed for the treatment of dry eye in humans. The drug promotes nonglandular secretion of fluid probably by water transport via activation of chloride channels, as well as the secretion of mucin and possibly the production of lipids by meibomian glands. Diquafosol was found to be safe and rapidly metabolized on the ocular surface (4).
In the lacrimal gland, cornea and tear film were discovered TrKA receptors. This receptors bind nerve growth factor – NGF. Topical administration of 100 µl of NGF twice daily was shown to significantly increase STT values, corneal sensitivity and mucin production (4, 15, 17).
Veterinary ophthalmologist have been administering pilocarpine at 1% or 2%, topically or systemically as an adjuvant to the treatment of neurogenic KCS in dogs unresponsive to CsA. Administration of pilocarpine can cause side effects due to parasympathetic intoxication. Dilution of pilocarpine to a concentration of 0,25% in artificial tears minimizes the occurrence of inflammatory reactions (4).
While most cases of KCS can be successfully managed with long-term medications, some animals may not respond favorably. Such patients needs surgical procedure. The surgical procedure recommended is the Parotit Duct Transposition. However, the procedure can led to side effects such as the formation of calcium granules retained in the tarsal plate, which may obstruct the transplanted duct (4, 17).
Dry eye in most animals carriers a good prognosis for successful treatment, but is dependent on the underlying cause. Treatment is generally most successful if it is diagnosed early and medical therapy is consistently administered as prescribed (18).
REFERENCES
- Samuelson D. A. : Ophthalmic Anatomy. In Veterinary Ophthalmology. Ed. Kirk N. Gelatt -4th ed, volume 1, 2007, Blackwell Publishing, pp 46-47.
- Bryla P. K.: Suche zapalenie rogówki i spojówek u psów. Życie Weterynaryjne, 2007, 82, 8, 668-671.
- Hartley C., Williams D. l., Adams V. J.: Effect of age, gender, weight and time of day on tear production in normal dogs. Vet. Ophthalmol. 2006, 9, 53-57.
- Riberio A., P., da Cunha Brito F., da Costa Martins B. et. al. : Qualitative and quantitative tear film abnormalities in dogs. Cienc. Rural. 2008, v 38, 2, Mar./Apr.
- Grahn B., H., Storey E., S.: Lacrimomimetics and lacrimostimulants. Veterinary Clinics of North America: Small Animal Practice, 2004, v. 34, 3, 739-753.
- Kański J., J.: Okulistyka Kliniczna. Górnicki Wydawnictwo Medyczne, 2 wyd,, Wrocław 2005, pp. 57-59.
- Wilkie D., A., Wolf E., D.: Sulphonamides and keratoconjunctivitis sicca. J Am. Vet. Med. Assoc. 1990, 196, 4, 521-522.
- Herring I., P. et al. Evaluation of aqueous tear production in dogs following general anesthesia. J. Am. and Anim. Hosp. Assoc. 2000, 36, 5, 427-430.
- Izci C., Celik L., Alkan F., et al.: Histological characteristics and local cellular immunity of the gland of the third eyelid after topical ophthalmic administration of 2% CsA for treatment of dogs with KCS. Am. J. Vet. Res. 2002, 63, 688-694.
- Williams D., L., Pierce V., Mellor P., Heath M., E.: Reduced tear production in three canine endocrinopathies. J. Small Anim. Pract. 2007, 8, 252-256.
- Miller – Smith S., J.: Keratoconjunctivitis sicca. Darvin Vet. Ctr. Ld. 2007. Materialy pozyskane z internetu, http://www.darwinvets.com.
- Hamor R., E., Roberts S., M., Severin G., A., Chavkin M., J.: Evaluation of results for Schirmer tear test conducted with and without application of a topical anesthetic in clinically normal dogs of 5 breeds. Am. J. Vet. Res. 2000, 61, 1422-1425.
- Madany J., Wiśniewska M.: Cyclosporyna – jej właściwości i zastosowanie w okulistyce u małych zwierząt. Annales Universitas Marie Curie Skłodowska. 2005, 60, 30-34.
- Berdoulay A., English R., V., Nadelstein B: Effect of topical 0,02% tacrolimus aqueous suspension on tear production in dogs with KCS. Vet. Ophthalmol. 2005, 8, 225-232.
- Coassin M., Lambiase A., Costa N. et al.: Efficacy of topical NGF treatment in dogs affected by dry eye. Ciraetes Arch. Clin. Exp. Ophthalmol. 2005, 243, 151-155.
- Kaswan R.: Cyclosporine for Veterinary Use. Materiały pozyskane z internetu http://www.wedgewoodpetrx.com/learning -center.
- Keratoconjunctivitis sicca . Published on Darwin Veterinary Centre. Materiały pozyskane z internetuhttp://www.darvinvets.com.
- Eaton Seth J.: Keratoconjunctivitis sicca (KCS, “Dry Eye”). Vetvine . Materiały pozyskane z internetu http://www.vetvine.com.
Dr n. wet. Przemysław K. Bryła
Przychodnia weterynaryjna w Warszawie
brylapik@wp.pl
THE FELINE GLAUCOMA
Aqueous humor is produced by the ciliary body by active secretion and filtration of plasma. Most of the aqueous humor flows from the posterior chamber, through the pupil, to the anterior chamber, and exit at the iridocorneal angle into the intrascleral venous plexus. The balance between formation and drainage maintains intraocular pressure. In glaucoma the pressure in the eye increased. Prolonged or recurrent elevation of intraocular pressure lead to degeneration of the retina and optic nerve. The presence of a “red eye”, corneal edema, mydriasis, blepharospasm, blidness, and buphtalmos can be seen. Pupillary light reflex may be slow or absent.
Glaucoma is divided into primary (including congenital) and secondary categories. The iridocorneal angle may be open, narrow or closed in either type. The primary glaucoma in cats is a heredietary condition. Secondary glaucoma is more commonly encountered than primary. Secondary glaucoma is most frequently due to severe anterior uveitis or iris melanoma. The elevation of intraocular pressure results from other disease processes within the eye. Feline aqueous humor misdirection syndrome is a unique form of glaucoma seen in cats. Aqueous humor is misdirected posteriorly into the vitreous instead of anteriorly in the anterior chamber. The objectives of therapy are to maintain vision and eliminate pain by increasing aqueous outflow, decreasing aqueous production and preventing or delaying glaucoma in the other eye. Aggressive medical (topical beta-blockers and carbonic anhydraze inhibitor) and possibly surgical therapy ( YAG laser, partial vitrectomy or lens removing) is indicated if the eye still has vision. If the eye is reversibly blind enucleation procedures should be performed.
KEYWORDS: feline glaucoma, primary glaucoma, secondary glaucoma , congenital glaucoma, Feline Aqueous Humor Misdirection Syndrome.
Jaskra to grupa chorób oczu, w których na skutek podwyższonego ciśnienia wewnątrzgałkowego dochodzi do upośledzenia procesu widzenia. W przypadku, gdy podwyższonemu ciśnieniu nie towarzyszy zaburzenie widzenia, mówimy o nadciśnieniu ocznym (1). Jaskra powstaje w wyniku zaburzonego odpływu cieczy wodnistej, przy równoczesnym procesie jej stałego wydzielania. Wzrost objętości cieczy wodnistej przekłada się na wzrost ciśnienia śródgałkowego. Zwiększone ciśnienie jest jednym z czynników, które prowadzi do niszczenia komórek zwojowych siatkówki i nerwu wzrokowego (2).
WYTWARZANIE I ODPŁYW CIECZY WODNISTEJ.
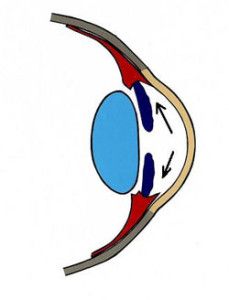
Ryc. 1. Drogi odpływu cieczy wodnistej.
Krążenie cieczy wodnistej w gałce ocznej oparte jest głównie na zasadzie grawitacji i konwekcji. Ruchy głowy oraz różnice temperatur pomiędzy rogówką a wnętrzem oka wywierają także duży wpływ na jej krążenie. Natomiast nieznaczną rolę pełni tu transport aktywny (2). Ciecz wodnista z komory tylnej oka, poprzez otwór źreniczny, przepływa do przedniej komory oka, aby dalej poprzez kąt przesączania ujść do zatoki żylnej twardówki (3). Taki sposób odpływu cieczy wodnistej nazywany jest drogą konwencjonalną; jest to główna droga, którą odpływa około 90% cieczy wodnistej. Pozostałe 10% odpływa drogą naczyniówkowo-twardówkową, zwaną niekonwencjonalną, która polega na przepływie cieczy przez ciało rzęskowe do przestrzeni nadnaczynówkowej i drenowaniu jej przez krążenie żylne w ciele rzęskowym, naczyniówce i twardówce (2).
Przestrzeń zawarta pomiędzy tylną obwodową powierzchnią rogówki a przednią nasadą tęczówki tworzy kąt przesączania, którego konfiguracja związana jest z patogenezą jaskry. Do badania i analizy kąta przesączania służy gonioskopia. Gonioskop to niewielki przyrząd optyczny nakładany po znieczuleniu oka bezpośrednio na rogówkę, umożliwia on identyfikację patologicznych struktur kąta i ocenę jego szerokości (4). Kąt przesączania tęczówkowo – rogówkowy składa się z więzadeł grzebieniastych (pectinate ligaments), szczelin rzęskowych (ciliary cleft), siateczki beleczkowej (trabecular meshwork) i kanałów odprowadzających ciecz wodnistą do żył zatoki żylnej twardówki. Więzadła grzebieniaste to różnych kształtów i rozmiarów wyrostki tęczówki, które penetrują obwodową rogówkę na granicy z twardówką. Pełnią one rolę filarów tkanki naczyniowej w kącie przesączania. Wysokość więzadeł grzebieniastych warunkuje stopień szerokości kąta przesączania. Im więzadła wyższe, tym kąt przesączania szerszy. Szerokość tego kąta jest istotna dla procesu odpływu cieczy wodnistej (5,6). Wolne przestrzenie w ciele rzęskowym zwane szczelinami, tworzą zachyłki, w których ma swój początek siateczka beleczkowa. Zbudowana jest ona z licznych warstw kolagenu i elastyny pokrytych płaskim śródbłonkiem. Siateczka beleczkowa pełni rolę filtru w kącie przesączania.

Ryc. 2. Budowa kąta przesączania tęczówkowo-rogówkowego.
Szczeliny natomiast zlewają się w kanały, które łącząc się ze sobą uchodzą do systemu żył oka (6).
Przednia i tylna komora oka wypełnione są przezroczystym płynem, zwanym cieczą wodnistą. Ciecz ta zawiera minimalne ilości białka i lipidów, zjonizowane elektrony i jony organiczne, glukozę, aminokwasy oraz układy enzymatyczne w ilościach zbliżonych do stężeń osocza krwi. Stałość składu chemicznego i właściwości fizycznych cieczy wodnistej zapewnia bariera komorowo – naczyniowa. Podłożem strukturalnym tej bariery jest śródbłonek naczyń włosowatych tęczówki i nabłonek ciała rzęskowego, które jest rodzajem gruczołu rozpościerającym się jak kryza wokół tylnej komory oka (7). Składa się ono z części przedniej – sfałdowanej i z części tylnej – płaskiej. Część sfałdowana zbudowana jest z promieniście ułożonych wyrostków, skierowanych w stronę tylnej komory oka, pokrytych nabłonkiem barwnikowym i bezbarwnikowym. Każdy z tych wyrostków ma centralnie przebiegającą tętniczkę, która kończy się bogatą siecią włośniczkową. Ścisłe połączenia pomiędzy sąsiadującymi komórkami warstwy pozbawionej barwnika stanowią barierę krew – ciecz wodnista (2). Ciecz wodnista jest aktywnie wydzielana przez nabłonek pozbawiony pigmentu w wyniku procesu metabolicznego, który zależy od działania wielu układów enzymatycznych, zwłaszcza od pompy ATP-azy sodowo-potasowej. W procesie tym znaczną rolę odgrywa enzym anhydraza węglanowa. W skutek różnicy ciśnień osmotycznych w oku, dochodzi również do biernego przepływ płynu, ale proces ten u zwierząt odgrywa minimalną rolę w produkcji cieczy wodnistej, stanowiąc u kota 3% objętości cieczy wodnistej a wielkość produkcji tej cieczy u kota wynosi około 14-20 ml/min (8, 9). Prawdopodobnie z wiekiem wielkość produkcji cieczy wodnistej maleje (8).
Krążenie krwi w błonie naczyniowej oka oraz wydzielanie cieczy śródocznych i ich prawidłowy przepływ zapewnia odpowiednie ciśnienie we wnętrzu gałki ocznej. Odpowiednio wysokie ciśnienie śródgałkowe konieczne jest do utrzymania optycznej krzywizny rogówki, gładkości jej powierzchni i stałego współczynnika załamania (7). Ciecz wodnista wypełniając przednią część oka odgrywa ważną rolę w stosunku do soczewki i rogówki. Elementy optyczne oka nie mają własnych naczyń krwionośnych, a rolę zaopatrzenia w tlen i składniki odżywcze spełnia tu ciecz wodnista (9). Ciśnienie śródoczne zależy od równowagi pomiędzy objętością tworzonego płynu, a jego odpływem. U kota za prawidłowe ciśnienie wewnątrz gałki ocznej przyjęto wartości poniżej 31 mmHg (3,10). Wartości te zależą między innymi od rasy, płci i wieku zwierzęcia jak również od metody pomiaru, doświadczenia osoby badającej. Pomiar ciśnienia śródgałkowego wykonuje się za pomocą tonometrów. Tonometria jest obiektywnym pomiarem ciśnienia polegającym na wywieraniu znacznej siły, koniecznej do spłaszczenia lub wgłobienia rogówki. Znanych jest kilka rodzajów tonometrów, które mają zastosowanie w okulistyce weterynaryjnej. Z punktu widzenia lekarza weterynarii, idealnym tonometrem jest Tonovet. Metoda ta umożliwia szybki i dokładny pomiar ciśnienia wewnątrzocznego bez stosowania środków znieczulających. Stosowanie jednorazowych sond eliminuje prawdopodobieństwo zakażeń. Wynik pomiaru podawany jest w mmHg (11).
Zaobserwowano, że oko kota jest bardziej odporne na uszkodzenia powodowane wysokim ciśnieniem śródocznym w porównaniu do oczu innych zwierząt. U kota nawet długotrwające wysokie ciśnienie śródgałkowe nie powoduje ślepoty, a objawy kliniczne jaskry zwykle są słabiej wyrażone (12).
W ostrej fazie jaskry ciśnienie wewnątrzgałkowe nierzadko osiąga wartość 70 – 80 mmHg (13). Oko w takim stanie jest bolesne, co zwierzęta manifestują mrużeniem powiek, pocieraniem głową o przedmioty, czy też tarciem oka łapą. Obserwuje się nadmierne łzawienie, przekrwienie naczyń krwionośnych i obrzęk spojówek. Oko staje się „czerwone”. Zwierzęta tracą apetyt, są osowiałe, unikają światła i więcej śpią. W miarę postępu choroby gałka oczna powiększa się powodując powstanie woloocza. Na powiększonej gałce ocznej często nie domykają się powieki co zaburza pracę filmu łzowego i prowadzi do powstania licznych keratopatii. Na skutek obrzęku mętnieje powierzchnia rogówki i mogą pojawić się w niej mętne linie zwane liniami Haabs’a – są to wygojone pęknięcia błony Descemeta. Źrenice ulegają rozszerzeniu i zwykle słabo bądź wcale nie reagują na bodziec świetlny. Często obserwuje się anizoscorię – różne wielkości źrenic. W soczewce na skutek stagnacji krążenia tworzą się katarakty. Powiększenie objętości gałki ocznej narusza przyczepy soczewki, prowadząc do jej zwichnięcia lub przemieszczenia do komór oka. W wyniku zwiększonej przepuszczalności ścian naczyń włosowatych, do komór oka napływają cząsteczki białka, powodując zapalenie błony naczyniowej oka (uveitis) lub rzekome zapalenie błony naczyniowej oka (pseudouveitis). Zmiany charakterystyczne dla jaskry występują zazwyczaj w jednym oku, ale nie jest wykluczone występowanie ich równocześnie lub z pewnym opóźnieniem w obu oczach. Jaskra jest chorobą nieuleczalną i postępującą, która niszcząc nerw wzrokowy prowadzi do nieodwracalnej ślepoty (6,12,14,15,16,17).
RODZAJE JASKRY
Nazwa jaskra obejmuje wiele jednostek chorobowych. Ponieważ patofizjologia, objawy kliniczne i leczenie różnych typów jaskry są różne, nie ma jednej definicji, która odpowiednio określałaby wszystkie jej odmiany, jednak ogólnie jaskrę podzielić możemy na pierwotną i wtórną.
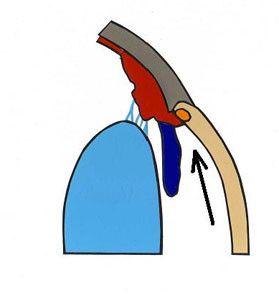
Ryc. 3. Otwarty kąt przesączania.
W praktyce klinicznej stosuje się również podział anatomiczny wynikający z budowy kąta przesączania. Wyróżniamy tu jaskrę z szerokim, otwartym kątem (Ryc.3.) i jaskrę z wąskim, zamykającym się kątem przesączania (Ryc. 4.), (2,13).
Określenie jaskra pierwotna oznacza, że przyczyna, która powoduje utrudniony odpływ cieczy wodnistej z oka nie jest wynikiem żadnej innej choroby oka. Taki rodzaj jaskry przekazywany jest z rodziców na potomstwo. Rozwija się w obu oczach, choć najczęściej niesymetrycznie; proces chorobowy zajmuje najpierw jedno oko, a następnie drugie. Ten typ jaskry jest rzadko spotykany u kotów. Przyczyną jej jest goniodysgeneza elementów kąta tęczówkowo-rogówkowego (goniodysgeneza – wrodzona dysplazja elementów wchodzących w skład budowy kąta przesączania (18), oraz odkładanie się w nim glikoaminoglikanów. Prowadzi to do stopniowego zwężania się kąta przesączania (19).
Jaskra wtórna jest postacią jaskry powodowaną inną chorobą oczu np. urazem, zapaleniem, nowotworem lub chorobami ogólnymi, w przebiegu których wytwarza się w oku znacznie podwyższone ciśnienie śródgałkowe, powodujące uszkodzenie nerwu wzrokowego. Charakterystyczną cechą tej postaci jaskry jest występowanie zmian zazwyczaj w jednym oku. U zwierząt domowych takich jak kot, najczęściej mamy do czynienia z jaskrą wtórną z wąskim lub szerokim kątem przesączania (3,12,13,16,17).
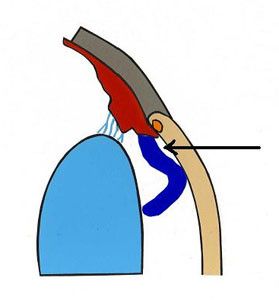
Ryc. 4. Zamknięty kąt przesączania.
Jaskra wtórna otwartego kąta wynika z patologii w obrębie utkania beleczkowego i dalszych dróg odpływu cieczy z oka. Najbardziej typowymi postaciami tej jaskry są : jaskra związana z uwalnianiem białek z przejrzałej soczewki (fakolityczna); jaskra barwnikowa, w przebiegu której drobiny melaniny uwolnione z tęczówki blokują odpływ w kącie przesączania; jaskra torebkowa, złuszczone komórki z torebki soczewki zatykają kąt przesączania; hemolityczna po wylewie krwi do oka; jaskra po urazach oka oraz jaskra polekowa. Tę ostatnią postać spotyka się po długotrwałym stosowaniu leków sterydowych. Dochodzi wówczas do zmiany struktury siateczki beleczkowej. Niekiedy jaskra rozwija się jako następstwo przebytej operacji oka, co może wynikać z uszkodzenia struktur oka i powstania blizn oraz zrostów. Ponadto w przebiegu zapaleń błony naczyniowej oka mogą tworzyć się zmiany bliznowate w rejonie kąta przesączania, prowadząc do jaskry (2,12,20, 21).
Jaskra wtórna zamkniętego kąta wynika ze zmian w obrębie kąta przesączania, które w sposób mechaniczny utrudniają prawidłowy dostęp cieczy wodnistej do siateczki beleczkowej (12,20). Przeszkodę tę mogą stanowić; patologiczna nasada tęczówki, guzy, nieprawidłowe naczynia, zrosty powstające w obrębie źrenicy, bądź zmiany związane z soczewką. Wyróżnić tu możemy kilka postaci jaskry: jaskrę fakotopiczną – wynikającą z przemieszczenia soczewki, jaskrę fakomorfotyczną powodowaną nieprawidłowym kształtem soczewki i jej pęcznieniem w przebiegu zaćmy (20,21) oraz jaskrę wywołaną zespołem zaburzonego kierunku przemieszczania się cieczy wodnistej (FAHMS – Feline Anterior Humor Misdirection Syndrome), (22). Tą postać jaskry określa się też terminem „jaskra złośliwa – glaucoma malignant” lub „blok ciało rzęskowe-ciało szkliste-soczewka”. Termin jaskra złośliwa odzwierciedla duży stopień trudności leczenia tej formy jaskry. Taki typ jaskry rozwija się wówczas, gdy ciecz wodnista, zamiast do komory tylnej oka, a następnie do komory przedniej i do kąta przesączania odprowadzana jest do jamy ciała szklistego lub pomiędzy ciało szkliste a siatkówkę.
Fot. 1. Jaskra złośliwa u kota wystąpiła w lewym oku. Szeroka, nie reagująca na światło źrenica. Płytka komora przednia.
W błonie szklistej ciała szklistego tworzą się mikropęknięcia, które działają jak zastawki jednokierunkowe. Stały napływ płynu prowadzi do wzrostu objętości ciała szklistego i jego ekspansji w stronę rogówki. Skutkuje to pchaniem soczewki w stronę komory przedniej oka. Soczewka, zachowując obwódkę rzęskową w nienaruszonym stanie, pociąga za sobą tęczówkę. Tęczówka kurczy się i stając się mięsista zasłania kąt przesączania. Obecna w komorze przedniej oka soczewka powoduje jej spłycenie. Spłycenie komory przedniej oka, widoczne w badaniu lampą szczelinową, utrudnia odpływ cieczy wodnistej z oka. Takiemu typowi jaskry towarzyszy maksymalnie rozszerzona źrenica, która nie reaguje na bodźce świetlne (23). Ciśnienie płynu śródgałkowego w tego typu jaskrze nie zawsze jest podwyższone (18). Jaskra złośliwa występuje zwykle u kotów starszych powyżej 11 roku życia, przeważnie u kotek i dotyczy około 1% ich populacji (18,22). Zmiany na dnie oka u chorych kotów są trudne do zaobserwowania, ponieważ w soczewce pojawiają się zaćmy, a ciało szkliste zatraca swoją przezroczystość (23), (Fot.1.)
LECZENIE JASKRY
Celem leczenia jaskry jest utrzymanie funkcji widzenia na możliwie najlepszym poziomie. Lecząc jaskrę mamy możliwość wpływania tylko na ciśnienie panujące wewnątrz oka. Dla każdego zajętego przez jaskrę oka istnieje indywidualny poziom ciśnienia, który jest bezpieczny. Ten bezpieczny poziom ciśnienia nazywany jest ciśnieniem docelowym, które może się zmieniać w ciągu życia. Można je osiągnąć stosując leki zmniejszające produkcję cieczy wodnistej oraz leki ułatwiające jej odprowadzanie z oka. W przypadku braku zahamowania choroby leczeniem farmakologicznym, należy zastosować zabiegi chirurgiczne zmniejszające produkcję cieczy wodnistej lub ułatwiające jej odpływ do przestrzeni podspojówkowej.
Leczenie farmakologiczne jaskry u kotów oparte jest na kroplach podawanych bezpośrednio na powierzchnię oka (12,13). Obecnie stosuje się dwie grupy leków; są to: betablokery oraz inhibitory anhydrazy węglanowej (12, 23). Betablokery zmniejszają produkcję cieczy wodnistej i stosować należy je 2- 3 razy na dobę. Przy przedawkowaniu mogą zaostrzać u kotów objawy astmy oskrzelowej i powodować bradykardię (24).
Inhibitory anhydrazy węglanowej również zmniejszają produkcję cieczy wodnistej, ale dodatkowo też rozszerzają naczynia krwionośne w tkankach oka, co redukuje niedokrwienie w jaskrze. W Polsce dostępne są np. 2% Dorzolamid i 1% Brinzolamid. Stosuje się je po jednej kropli 3 – razy dziennie. Przy czym lepiej przez koty tolerowany jest Bronzolamid (25). Inhibitory anhydrazy węglanowej dostępne w postaci tabletek źle są tolerowane przez koty i nie powinno się ich stosować w leczeniu jaskry (18). Dobrym rozwiązaniem w leczeniu jaskry u kotów jest zastosowanie preparatu Cosopt – MSD Polska. Cosopt jest połączeniem betablokera z inhibitorem anhydrazy węglanowej (12).
W przypadku, gdy możliwości leczenia farmakologicznego zostaną wyczerpane, należy rozważyć zabieg chirurgiczny (12,16,17,26). Wszystkie zabiegi operacyjne mają na celu obniżenie ciśnienia w oku. Laserem można wykonać trabekuloplastykę – otwarcie przymknietych otworków filtracyjnych w jaskrze otwartego kąta – oraz irydotomię, zabieg stosowany w jaskrze z wąskim kątem przesączania. Światłem laserowym wykonuje się mały otworek w tęczówce, który pozwala na przepływ cieczy wodnistej z tylnej komory oka do przedniej. U kotów nie stosuje się zabiegów niszczących ciało rzęskowe, nie podaje się prostaglandyn ani nie stosuje gonioimplantów. Również zabieg wprowadzenia do oka silikonowej protezy nie przynosi pożądanych efektów kosmetycznych (inny kształt źrenicy oka oraz kolor tęczówki).
Radykalną metodą postępowania w przypadku nie leczonej i zaniedbanej jaskry, w której doszło do nieodwracalnej ślepoty, jest zabieg wypatroszenia oczodołu (12,13). Zabieg jest łatwy do wykonania i szybko przynosi ulgę cierpiącemu zwierzęciu. W przypadku jaskry złośliwej opornej na leczenie farmakologiczne stosuje się częściową witrektomię oraz /lub usunięcie z oka soczewki (23).
PIŚMIENNICTWO
- Miller P.E., Pickett J.P., Majors U.: The efficacy of topical prophylactic antiglaucoma therapy in primary closed angle glaucoma in dogs; a multicenter clinical trials. J. Am. Hosp. Assoc. 2000, 36, 431-443.
- Kański J.J. : Okulistyka Kliniczna, Górnicki Wydawnictwo Medyczne, 2 wyd., Wrocław 2005, s. 192-269.
- Bedford P.G.C., Grierson I.: Aqueous drainage in the dog. Res. Vet. Sci. 1986, 41, 172-186.
- Martin C.L.: Gonioscopy and anatomical correlations of the drainage angle in the dog. J. Small Anim. Pract. 1969, 10, 171-184.
- Barrie K.P., Gum G.G., Samuelson D.A., Gelatt K.N.: Morphologic studies of uveoscleral outflow in normotensive and glaucomatous Beagles with fluorescein-labeled dextran. Am. J. Vet. Res. 1985, 46, 1, 89-97.
- Whiteman A.L.: Morphologic and immunohistochemical features of canine acute primary angle closure glaucoma. Invest. Ophtalmol. Vis. Sci. 2000, 41, 516-521.
- Bernat R.: Zmysł wzroku. W: Fizjologia człowieka z elementami fizjologii klinicznej. Wydana przez Traczyk W., Trzebski A. PZWL Warszawa 1980, s.109-110.
- Peiffer Jr R.L., Gellat K.N., Gum G.G.: Determination of the facility of aqueous humor outflow in the dog, comparing in vivo and in vitro tonographic and constant pressure perfusion technique. Am. J. Vet. Res. 1976, 37, 1473-1477.
- Barrie K.P., Gum G.G., Samuelson D.A., Gellat K.N.: Quantitation of uveoscleral outflow in normotensive and glaucomatous Beagels by 3-H labeled dextran. Am. J. Vet. Res. 1985, 46, 84-88.
- Miller P.E., Pickett J.P., Majors U.: In vivo and in vitro comparison of Mackay-Marg and Tono-pen applanation tonometers in dogs and cats. The nineteenth annual scientific program of the American College of Veterinary Ophtalmologists. Las Vegas, Nevada, 1988. Materiał pozyskany z internetu.
- TonoVet – Instrukcja obsługi i konserwacji. Przychodnia weterynaryjna w Warszawie, ul Hawajska 16. Materiał własny.
- Miller P.E.: Glaucoma.: W: Kirk’s Current Vet. Therapy XII Small Anim. Pract. Wydana przez Bonagura J.D., Sanders W.B., Philadelphia 1995, s.1265-1272.
- Miller P.E.: Glaucoma; Diagnosis and Therapy. Waltham Symposium. Small Anim. Ophtalmol. 2001. Materiały pozyskane z internetu, www.vin.com.
- Gelatt K.N., Gum G.G.: Inheritance of primary glaucoma in the Beagel. Am. J. Vet. Res. 1981, 42, 1691-1693.
- Smith R.I.E., Peiffer Jr. R.L., Wilcook B.P.: Some aspects of the pathology of canine glaucoma. Prog. Vet. Comp. Ophtalmol. 1993, 3 , 16-18.
- Dietrich U.: Feline glaucomas. Clin. Tech. Small Anim. Pract. 2005, May, 20, 108-116.
- Brooks D.E.: Glaucoma in the dog and cat. Vet. Clin.North Am. Small Anim Pract. 1990, 20, 775-797.
- Czederpiltz J.M.C., el al.: Putative aqueous humor misdirection syndrome as a cause of glaucoma in cats : 32 cases (1997-2003). J. Am. Vet. Med. Ass. 2005, 1, (227), 1434-1441.
- Ofri R.: Medical Therapy of Glaucoma. EJCAP. 2007, (17), 3, 285-288.
- Gelatt K.N., MacKay E.O.: Secondary glaucoma in the dog in North America. Vet. Ophtalmol. 2004, 7, 4, 243-259.
- Niżankowska M.H.: Jaskra. Przewodnik diagnostyki i terapii. Górnicki Wydawnictwo Medyczne. 2001, s.86-106, s.119-129.
- Miller P. E. Jaskra. W: Okulistyka weterynaryjna Slattera. Wydana przez Maggs D.J. , Miller P.E., Ofri R.,Elsevier Wrocław 2009, s.255-274.
- Van der Woerdt A. Feline Ophtalmology. Waltham OSU Symposium 2001. Small Animal Ophtalmology. http://www.vin.com.
- Wilkie D. A., Latimer C. A. Effects of topical administration of timolol maleate on intraocular pressure and pupil size in cats. Am. J Vet. Res. 1991, 52, 436-435.
- Rainbow M. E. ,Dziezyc J. Effect of twice daily application of 2% dorzolamide on intraocular pressure In normal cats. Vet. Ophtalmol. 2003, 6, 143-150
- Brooks D.E.: Current concepts in veterinary ophthalmology. 2003. Materiały pozyskane z internetu, http://sacs.vetmed.ufl.edu.
Przemysław K. Bryła
VITREOUS HUMOR AND DESEASES
The vitreous humor is the largest structure in the eye. It is a transparent, jellylike humor that fills the posterior cavity of the eye. As a results, the vitreous functions to transmit light, to maintain the shape of the eye, and to help maintain the normal position of the retina. Embriologically, the vitreous is described as three components: primary, secondary and tertiary vitreous. The vitreous is 98% water, collagen and hyaluronic acid comprise 1-2%. The vitreous proper has very few cells and most of them are hyalocytes. Variable persistence of the hyaloid occurs in association with many other type of malformations. Small remnants of the hyaloids vasculature are encountered behind the central posterior lens capsule. Frequently seen vitreous abnormalities include vitreous strands, asteroid hyalosis, hemorrhage and infiltration within inflammatory cells. Vitreous opacities tend to move slightly or oscillate within the gel vitreous after eye movements.
KEYWORDS: vitreous humor, dog vitreous, hyaloid persistence, PTVL, PHPV, vitreous opacities.
EMBRIOLOGIA, ANATOMIA I FIZJOLOGIA CIAŁA SZKLISTEGO
Ciało szkliste (corpus vitreaum), ma kształt kuli spłaszczonej od przodu ku tyłowi i jest utworzone z przejrzystej, galaretowatej substancji zawierającej około 98% wody. Wypełnia ono całkowicie komorę ciała szklistego gałki ocznej (camere vitrea bulbi). Komora ta ograniczona jest od przodu przez soczewkę i ciało rzęskowe a z pozostałych stron przez siatkówkę (1).
Ryc.1 Topografia ciała szklistego
Podczas rozwoju embrionalnego powstaje ciało szkliste pierwszorzędowe (pierwotne), drugorzędowe (wtórne) oraz trzeciorzędowe (2). Pierwotne ciało szkliste znajduje się pomiędzy prymitywną soczewką a wewnętrzną warstwa kielicha wzrokowego. W ciele tym występują głównie naczynia krwionośne systemu ciała szklistego, ale też obecne są nieliczne komórki mezenchymalne, makrofagi, hyalocyty i włókna kolagenowe. Rolą naczyń krwionośnych systemu ciała szklistego jest odżywianie soczewki podczas procesu embriogenezy. W okresie zamykania się szczeliny płodowej wokół ciała szklistego pierwszorzędowego narasta ciało szkliste drugorzędowe. Ciało to posiada matrycę komórkową , którą stanowią prymitywne hyalocyty, monocyty i cząsteczki kwasu hialuronowego oraz uporządkowaną sieć włókien kolagenowych (3). W drugorzędowym ciele szklistym zawartość białka obniża się z 12% do 4%, a prymitywne hyalocyty zaczynają produkować włókna kolagenowe, które przyczyniają się do wzrostu objętości drugorzędowego ciała szklistego (4). Ostatecznie z niego powstaje dojrzała postać ciała szklistego wtórnego (2).
Ciało szkliste trzeciorzędowe występuje w postaci cienkiej warstwy włókien kolagenowych. Układają się one pomiędzy biegunem soczewki a kielichem wzrokowym. Włókna te nazywane są wiązkami Drualta i biorą udział w tworzeniu obwódki rzęskowej soczewki (5). W miarę wykształcania się ciała szklistego dojrzałego, ciało szkliste pierwotne ulega atrofii. Ulegają jej też naczynia krwionośne systemu ciała szklistego. W miejscu tętnicy ciała szklistego pozostaje przejrzysty kanał ciała szklistego, nazywany kanałem Cloquet’a (2).
Ryc.2 Topografia ciała szklistego I, II i III rzędowego.
Kolagen i kwas hialuronowy stanowią około 1-2% całkowitej objętości ciała szklistego. Włókna kolagenowe połączone są z kwasem hialuronowym glikoaminoglikanami (GAG). GAG składają się głównie z siarczanu chondroityny i siarczanu heparyny (6). W ciele szklistym obecne są w śladowych ilościach glikoproteiny tj. vitrinin, opticin, fibulin-1 (7). W ostatecznym dojrzałym ciele szklistym spotykamy małe ilości komórek, głównie są to hyalocyty obecne w okolicy kory ciała szklistego. Hyalocyty to histiocyty ze słabo rozwiniętym aparatem lizosomalnym. W okresie embrionalnym produkują one cząsteczki kwasu hialuronowego oraz mogą fagocytować inne komórki. Kwas hialuronowy zapewnia ciału szklistemu wysoką wiskoelastyczność (5). U zwierząt takich jak kot, pies kora ciała szklistego jest bardziej płynna w stosunku do gęściejszej jego części centralnej (3). Zaś wraz z wiekiem jego gęstość zmniejsza się. Proces ten nazywamy synerezą ciała szklistego (5). Z wyjątkiem kolagenu i cząsteczek kwasu hialuronowego skład cieczy wodnistej gałki ocznej i ciała szklistego jest podobny. Pomiędzy tymi dwoma środowiskami zachodzi swobodna wymiana wielu substancji (3).
W ciele szklistym wyróżnia się kilka obszarów. Obszar przedni – położony przed częścią rzęskową siatkówki oraz tylny – leżący za częścią rzęskową siatkówki. Obszar obejmujący obwodową część ciała szklistego nazywamy korą, zaś pozostałą część ciała szklistego – nazywamy częścią środkową ciała szklistego. W korze wyróżniamy podstawę ciała szklistego, zapewnia ona połączenie z częścią rzęskową siatkówki, oraz część okołobrodawkową, która sąsiaduje z tarczą nerwu wzrokowego (2, 3).
W przedniej części ciała szklistego występuje dół ciała szklistego (fossa hyaloidea) służący do pomieszczenia soczewki. Przy powierzchni zewnętrznej ciała szklistego sieć włókien kolagenowych ulega zagęszczeniu tworząc swego rodzaju błonę szklistą ( membrana vitrea). Włókna kolagenowe błony szklistej wnikają do błony granicznej wewnętrznej siatkówki. W ten sposób błona ta przytwierdza się do siatkówki, tym samym zapewniając trwałe połączenie tych struktur (1). Włókna kolagenowe przytwierdzają ciało szkliste także do torebki tylnej soczewki, części rzęskowej siatkówki i do głowy tarczy nerwu wzrokowego (2, 5).
Pomiędzy ciałem szklistym a częścią wewnętrzną siatkówki istnieje potencjalna przestrzeń. W przestrzeni tej w niesprzyjających warunkach patologicznych gromadzić się może krew i wysięk zapalny (2).
FUNKCJE CIAŁA SZKLISTEGO
Ciało szkliste jest największą strukturą gałki ocznej. Stanowi około 80% jej objętości. Odgrywa ważna rolę w okresie wzrostu i powiększania się gałki ocznej. Wydłużanie się ciała szklistego na skutek syntezy kolagenu, rekonfiguracji molekuł oraz uwodnienia cząsteczek kwasu hialuronowego wpływa korzystnie na stopień refrakcji. Przejrzystość ciała szklistego determinowana jest małą średnicą włókien kolagenowych oraz znacznym stopniem ich rozproszenia (8). Ważną rolę w utrzymaniu jego przejrzystości odgrywa też bariera krew-ciało szkliste. W warunkach fizjologicznych bariera ta zapobiega napływowi makrocząsteczek i komórek do ciała szklistego.
Ciało szkliste pełni też ważną rolę w neutralizowaniu i magazynowaniu metabolitów pochodzących z przemian w siatkówce. Gromadzone są tu: glikogen, aminokwasy, nadmiar jonów potasu, kwas mlekowy oraz wolne rodniki. Obecność tych substancji w ciele szklistym chroni soczewkę i rogówkę przed toksycznym ich wpływem (8). Poza tym ciało szkliste odpowiada za zachowanie anatomicznych proporcji i ułożenia niektórych struktur gałki ocznej, głównie soczewki i siatkówki. Wysoka wiskoelastyczność chroni delikatne tkanki oka przed urazami, zwłaszcza w czasie gwałtownych ruchów (REM – rapid eye movements), (3).
ZABURZENIA CIAŁA SZKLISTEGO WRODZONE I ROZWOJOWE
Z pośród zaburzeń wrodzonych i rozwojowych spotykanych w ciele szklistym wyróżnić należy: przetrwałą tętnicę ciała szklistego, przetrwała osłonkę naczyniową soczewki oraz przetrwałe hiperplastyczne pierwotne ciało szkliste (2, 3).
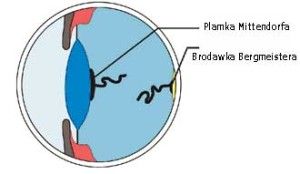
Ryc.3 Topografia plamki Mittendorfa i brodawki Bergmeistera.
W ciągu kilku tygodni po narodzinach u większości zwierząt tętnica ciała szklistego (HA- hyaloid artery) ulega atrofii. Wyjątek stanowią przeżuwacze, u których jest ona obecna przez całe życie. Czasami, z nieznanych powodów, resztki owej tętnicy potrafią przetrwać i u innych zwierząt. Stan taki określamy terminem przetrwała tętnica ciała szklistego (PHA – Persistent Hyaloid Artery). Resztki przetrwałej tętnicy możemy spotkać w okolicy tarczy nerwu wzrokowego lub w okolicy torebki tylnej soczewki. W badaniu oftalmoskopowym widoczne są czerwono-białe powrózki rozciągające się w ciele szklistym na różnej długości. Te wywodzące się z tarczy nerwu wzrokowego zmiany określamy terminem brodawki Bergmeistera. Natomiast pozostałości tylnego końca tętnicy przytwierdzone do torebki tylnej soczewki, zwykle do jej centralnej części, nazywamy plamką Mittendorfa (9).
Niekiedy przetrwała tętnica ciała szklistego może rozciągać się od tarczy nerwu wzrokowego aż do tylnej torebki soczewki. Jest to zaburzenie dziedziczone u psów rasy doberman i Sussex spaniel (10). Zmiany takie należy różnicować między innymi z zaćmą torebkową i podtorebkową tylną, ze szwami soczewki, pasmami ciała szklistego oraz z przetrwałą osłonką naczyniową soczewki (PTVL – Persistent Tunica Vasculosa Lentis) i przetrwałym hiperplastycznym pierwotnym ciałem szklistym (PHPV- Perisistent Hyperplastic Primary Vitreous), (2, 9).
Ryc.4 Topografia zmian charakterystycznych dla PHPV
Przetrwała osłonka naczyniowa soczewki (PTVL) jawi się jako siateczkowy cień na tylnej powierzchni soczewki. W zależności od nasilenia zmian i liczebności cieni na tylnej powierzchni torebki soczewki, wyróżniono sześć stopni tej nieprawidłowości. Stopień pierwszy mówi nam, że występują pojedyncze cienie, które nie wpływają na proces widzenia. Kolejne stopnie manifestują nasilenie zmian, które w efekcie prowadzą do zaburzeń w widzeniu (11).
W odróżnieniu do poprzednich nieprawidłowości, które są wynikiem braku atrofii układu naczyniowego ciała szklistego, przetrwałe hiperplastyczne pierwotne ciało szkliste (PHPV) powstaje w wyniku przerostu fragmentów układu ciała szklistego w okresie płodowym i po urodzeniu (12). PHPV klinicznie objawia się białym, mętnym lub włóknistonaczyniowym obszarem w przedniej części ciała szklistego.
Schorzenie to pojawia się u psów i kotów. U psów rasy bouvier des Flandres, Staffordshire bullterierów, dobermanów pinczer, sznaucerów miniaturowych jest formą dziedziczoną (2, 12). Często nieprawidłowość ta powiązana jest z innymi zmianami patologicznymi w gałce ocznej np. z mikroftalmią, mikrofakią, zaćmą oraz z dysplazją siatkówki (3).
ZABURZENIA CIAŁA SZKLISTEGO NABYTE
Istnieje wiele przyczyn, które mogą uszkodzić strukturę i funkcję ciała szklistego. Ponieważ nie jest ono unaczynione, zwykle nie rozwijają się w nim pierwotne zapalenia (2). Jednak zapalenia tkanek sąsiadujących z ciałem szklistym łatwo wywołują w nim : zmętnienia, krwotoki, synerezę i nacieki komórkowe (8). Do zakażenia ciała szklistego często doprowadza uraz perforujący, uogólniona infekcja oraz grzybicze zakażenie gałki ocznej (2). U starszych zwierząt często w ciele szklistym zaobserwować można strąty. Są to drobne, ruchome elementy. W większości przypadków nie mają one znaczenia klinicznego. Prawdopodobnie ich obecność wiąże się ze zwyrodnieniem ciała szklistego albo są pozostałością po przebytych przewlekłych chorobach zakaźnych (8).
W ciele szklistym obecne też są ciała gwiaździste oraz złogi cholesterolu. Ciała gwiaździste to cząsteczki złożone z wapnia i fosforu. Są one przytwierdzone do szkieletu kolagenowego ciała szklistego i poruszają się tylko wraz z ruchem głowy lub gałki ocznej. Natomiast cząsteczki cholesterolu spotykane w cholesterolozie poruszają się w uwodnionym ciele szklistym. Przypominają one wirujące płatki śniegu w kuli śnieżnej (3).
Kolejnym zaburzeniem ciała szklistego o charakterze nabytym jest jego zwyrodnienie (13). Polega ono na odseparowaniu płynu od stałych składników ciała szklistego. W ciele takim tworzą się oddzielne frakcje poszczególnych składników. Taki typ nieprawidłowości rozwija się u osobników starszych, spontanicznie lub na skutek przebytych chorób. Stanowi predyspozycję do odwarstwienia siatkówki. Zwyrodnienia ciała szklistego często występują u psów rasy whippet oraz Italian greyhound. U tych ras schorzenie to może mieć podłoże genetyczne (13).
Krwotoki do ciała szklistego zdarzają się stosunkowo rzadko. Najczęściej powodem krwotoku jest uraz siatkówki lub naczyniówki. Przyczyną krwotoków często są zaburzenia krzepliwości krwi (trombocytopenia), retinopatia nadciśnieniowa, urazy gałki ocznej, powikłania po przebytych operacjach wewnątrzgałkowych, wrodzone anomalie oczu – np. CEA – collie eye anomaly (14).
Dr n. wet. Przemysław K. Bryła
e-mail: brylapik@wp.pl
Przychodnia weterynaryjna w Warszawie
PIŚMIENNICTWO:
- Kobryń H., Kobryńczuk F. : Anatomia zwierząt, t. 3, Wydawnictwo Naukowe PWN Warszawa 2006, s. 211.
- Ofri R. : Ciało szkliste. W: Okulistyka Weterynaryjna Slattera, Wydana przez Maggs D.J., Miller P.E., Ofri R. Saunders Elsevier Wrocław, 2009, s.305-315.
- Cook S. C.: Ocular embryology and congenital malformations. W: Veterinary Ophtalmology. Wydana przez K. Galett, Blackwell Publishing, Wydanie IV, 2007, s. 17-18.
- Beebe D. C., et. al. :Transport and steady-state concentrations of plasma protein in the vitreous humor of the chicken embrio: Implications for the mechanisms of eye growth during early development. Dev. Biol, 1986, 114, 361-368.
- Samelson D. A.: Ophtalmic anatomy. W: Veterinary Ophtalmology. Wydana przez K. Galett, Blackwell Publishing Wydanie IV, 2007 s. 109-110.
- Goes R. M., et. al. : Chondroitine sulfate proteoglycans are structure renewable constituents of the rabit vitreos body. Curr. Eye Res. 2005, 30, 405-413.
- Bishop P. N., et. al. : The role of the posterior cillary body in the biosynthesis of vitreous humor. Eye, 2002, 16, 454-456.
- Gum G. G., Gelatt K. ,N., Esson D. : Physiology of the Eye. W: Veterinary Ophtalmology, Wydana przez Gelatt. K., Backwell Publishing Wydanie IV, 2007, s. 172-174.
- Zhu M., et. al. : The Human Hyaloid System: cell death an vascular regression. Exp. Eye Res. 2000, 70, 767-776.
- Browning J. A., et al. : Proximal arterial vasoconstraction procedes regression of the hyaloid vasculature. Curr Eye Res. 2001, 22, 405-414.
- Allgoewer I., Pfefferkorn B. : PHTVL and PHPV in two cats. Vet Ophtalmol. 2001, 4, 161-164.
- Graham B. H., et. al. : Inherited retinal dysplasia and PHPV in miniatur schnauzer dog. Vet. Ophtalmol. 2004, 7, 151.
- Lebrujere I. I., Hartley C., Rogers K., et. al.: USG evaluation of vitreous degenerations in normal dog. Vet. Radiol. Ultrasound, 2008, 49, 165-171.
- Crispin S. M. : Notes on Veterinary Ophtalmology, Blackwell Publishing Wydanie I, 2005, 150-155.
Przemysław K. Bryła
KERATOPLASTY
Certain pathologic conditions lead to a loss of corneal transparency. It may lead to visual disturbance. One method of the treatment can be conventional allogenic corneal transplants (penetrating or non -penetrating keratoplasty). In veterinary ophthalmology the logistics of obtaining corneal donor tissue are complicated. Another problem with getting a transplant from a dog is that the cornea may turn into scar tissue during the healing process. No Eye Bank exist for dog. Many conditions are associated with significant corneal stromal vascularization and infiltration, that contribute to graft rejection. Thus, artificial cornea would seem to represent an ideal for many blinding corneal condition in the dog. Artificial corneal implants are somewhat common in humans. They have been performed for several years. It has taken time for the procedure to take place in dogs.
KEYWORDS: keratoplasty, dog cornea, corneal dystrophy, corneal degeneration, corneal transparency, corneal graft, corneal implants.
BUDOWA ROGÓWKI
Rogówka (cornea) stanowi najbardziej zewnętrzną warstwę gałki ocznej. Wielkość, kształt, gładkość powierzchni oraz jej przejrzystość decydują o prawidłowej funkcji optycznej oka. U psów rogówka załamuje promienie świetlne z mocą 40-42 Dioptri. Jej grubość w części centralnej wynosi 0,45 – 0,55 mm, zaś w części obwodowej 0,5 – 0,65 mm (1).
Zewnętrzną warstwę rogówki stanowi nabłonek. Jest on złożony z 5-6 warstw komórek położonych na błonie podstawnej. Jest to nabłonek płaski, nierogowaciejący. W jego skład wchodzą komórki nabłonka podstawnego, komórki skrzydłowate oraz komórki powierzchniowe płaskie. Komórki podstawne z błoną podstawną łączą hemidesmosomy. Komórki nabłonka rogówki charakteryzuje intensywny metabolizm i aktywność mitotyczna. Wymiana ich odbywa się średnio co kilka dni. Pomiędzy komórkami występują liczne zakończenia czuciowe nerwu rzęskowego. Drugą warstwę rogówki stanowi błona podstawna. Tworzą ją zagęszczone włókna kolagenowe warstwy rogówki właściwej, czyli zrębu rogówki.

Ryc. 1. Schemat budowy rogówki.
Zrąb rogówki zbudowany jest z włókien kolagenowych, pomiędzy którymi znajduje się substancja mukopolisacharydowa i nieliczne komórki. Włókna kolagenowe ułożone są równolegle i w ten sposób tworzą zachodzące na siebie blaszki (lamele). Nieliczne komórki zrębu to: keratocyty, limfocyty, makrofagi i neutrofile. Ponadto w zrębie rogówki występują zakończenia nerwowe wrażliwe na zmiany ciśnienia (rozciąganie rogówki). Regularne ułożenie lameli oraz obfite uwodnienie (75% całkowitej masy zrębu) zapewnia rogówce wysoką przejrzystość. Kolejną warstwą rogówki jest błona graniczna tylna – błona Descemeta. Tworzą ją cienkie włókna kolagenowe. Błona ta jest produktem sekrecji komórek śródbłonka rogówki i grubość jej zwiększa się przez całe życie. Funkcją błony jest ochrona wnętrza gałki ocznej przed urazami mechanicznymi oraz szerzącymi się zakażeniami. Błona Descemeta, od strony komory przedniej gałki ocznej, pokryta jest śródbłonkiem rogówki. Zbudowany jest on z jednej warstwy komórek wielobocznego kształtu, które ściśle do siebie przylegają. Ich rolą jest stałe odwadnianie zrębu rogówki, co decyduje o stopniu jej przejrzystości. Śródbłonek rogówki odżywiany jest za pośrednictwem cieczy wodnistej z przedniej komory. Wraz z wiekiem osobnika zmniejsza się liczba komórek śródbłonka rogówki, gdyż nie posiada on zdolności proliferacyjnych. Jego fizjologiczne ubytki są kompensowane rozsuwaniem się sąsiadujących komórek. Utrata tych możliwości zwykle prowadzi do zmniejszenia przejrzystości rogówki (1,2).
Fizjologicznie rogówka nie posiada własnych naczyń krwionośnych ani chłonnych. Nie występują w niej żadne złogi ani barwniki (3). Powierzchnia rogówki pokryta jest przez przedrogówkowy film łzowy, który ją odżywia a zarazem chroni przed rogowaceniem nabłonka. Natomiast włókna kolagenowe zrębu rogówki przebiegające na wzór siatki dyfrakcyjnej zapewniają jej jak największą przejrzystość (3).
PRZYCZYNY OGRANICZAJĄCE PRZEJRZYSTOŚĆ ROGÓWKI
Istnieje szereg czynników i przyczyn, które upośledzają przejrzystość rogówki, a tym samym prowadzą do utraty widzenia (4). Mogą to być wrodzone anamalie rogówki (mała lub duża rogówka – microcornea i megacornea), które poprzez zaburzenia kształtu rogówki prowadzą do wad wzroku i złej ostrości widzenia.
Utratę przejrzystości rogówki powodują procesy zapalne wywołane czynnikami zakaźnymi tj. bakterie, wirusy, pasożyty czy też grzyby oraz czynniki niezakaźne, towarzyszące chorobom alergicznym i układowym. W przebiegu procesów zapalnych połączonych z uszkodzeniem rogówki, po wygojeniu mogą powstać trwałe blizny (2, 4).
Do kolejnej grupy czynników, które mogą upośledzić przejrzystość rogówki należą urazy. Mogą to być urazy mechaniczne, termiczne, chemiczne oraz promieniowanie (4).
Liczną grupą chorób, które w znacznym stopniu zaburzają przejrzystość rogówki są choroby dystroficzne rogówki. Zazwyczaj są to choroby wrodzone, dotyczą oboje oczu i są przekazywane z pokolenia na pokolenie. Ujawniają się już we wczesnym wieku (6 miesiąc życia) i postępują powoli. Wyróżnić możemy kilka typów dystrofii np. dystrofia zrębu rogówki (polegająca na odkładaniu się złogów lipidowych w przestrzeniach międzykolagenowych jak też w komórkach tam obecnych), dystrofia śródbłonka rogówki (często spotykana u boston terierów, pudli, jamników, shih tzu), dystrofia rogówki podnabłonkowa określana też terminem powierzchowna punktowa keratopatia (ten typ dystrofii często występuje u owczarka szetlandzkiego) oraz dystrofia błony podstawnej nabłonka rogówki stosunkowo często spotykana u psów rasy bokser (2, 4).
Do chorób ograniczających przejrzystość rogówki zalicza sie też schorzenie określane terminem stożek rogówki (keratoconus). Przypuszczalną przyczyną choroby jest szereg różnych uwarunkowań: genetycznych, środowiskowych, komórkowych. Mogą one prowadzić do zaburzeń funkcjonowania błony podstawnej nabłonka co skutkuje powstawaniem uwypukleń w centralnej części rogówki. Stożek ten powoduje zaburzenia refrakcji i w ten sposób upośledza sprawność narządu wzroku (5).
Obok dystrofii, do zaburzeń przejrzystości rogówki prowadzą też jej zwyrodnienia. Pojawiają się one w późniejszym wieku i nie są dziedziczone. Zwyrodnienia powodowane są odkładaniem się w rogówce różnorodnych złogów. Mogą to być ciała tłuszczowe, sole miedzi lub wapnia. Zwyrodnienia zwykle są wtórnym procesem po przebytych lub toczących się schorzeniach miejscowych lub ogólnych. Zmiany zwyrodnieniowe mogą obejmować każdą z warstw rogówki. Często towarzyszy im obrzęk, waskularyzacja, pogrubienie i pigmentacja rogówki. Odkładanie złogów lipidowych może również mieć związek z długotrwałą terapią kortykosteroidami (2, 4, 5).
Zaburzenia przejrzystości rogówki powodowane są też dysfunkcjami układu immunologicznego. Prowadzi to do powstania chorób o autoimmunologicznym charakterze. Organizm wyłamuje się spod wpływu mechanizmów kontrolujących, co powoduje załamanie się stanu tolerancji immunologicznej w stosunku do własnych antygenów. Przykładem choroby, o takim podłożu jest występujące u owczarków niemieckich, belgijskich, greyhoundów i ich mieszańców, przewlekłe powierzchniowe zapalenie rogówki (panus). Dokładna etiologia schorzenia nie jest znana. W rogówkach dotkniętych schorzeniem stwierdzono obecność odpowiedzi immunologicznej typu komórkowego skierowanej przeciwko antygenom rogówki i błony naczyniowej. We wczesnych fazach choroby dochodzi do proliferacji komórek rogówki i nacieku zrębu przez komórki plazmatyczne i limfocyty. W stadiach zaawansowanych waskularyzacji i pigmentacji ulega cała rogówka (2, 5).
PRZESZCZEP ROGÓWKI
U wielu pacjentów leczeniem farmakologicznym nie udaje się przywrócić pierwotnej funkcji rogówki a tym samym poprawić sprawności funkcji gałki ocznej. W takich przypadkach jedynym rozwiązaniem poprawiającym widzenie jest wykonanie przeszczepu rogówki (keratoplastyka). Przeszczep rogówki to chirurgiczne zastąpienie części rogówki gospodarza fragmentem rogówki pobranym od biorcy. Pierwszy udany przeszczep rogówki u człowieka wykonał E. K. Zirma w 1905 roku (7). Współcześnie na całym świecie wykonuje się przeszczepy allogeniczne, czyli takie w których dawcą jest osobnik tego samego gatunku (8). Transplantacja rogówki nie wymaga doboru dawcy i biorcy pod względem immunologicznym ale jego powodzenie zależy od stanu rogówki biorcy przed zabiegiem, jakości materiału pobranego od dawcy, jakości sprzętu używanego do transplantacji oraz doświadczenia chirurga. Generalnie materiał do przeszczepu pobierany jest od zwłok (9). Większość rogówek pobiera się w postaci płatka rogówkowo-twardówkowego i umieszcza w specjalnym płynie konserwującym. Płyn ten umożliwia przechowywanie i transport materiału. Do najpopularniejszych płynów należą Optisol GS oraz MK Medium (7).
Na zwiększenie liczby przeszczepów rogówki u człowieka znaczący wpływ miało stworzenie Banku Tkanek Oka. W Polsce rocznie wykonuje się około 500 przeszczepów rogówki, podczas gdy w USA około 50 tysięcy (5, 7). Niestety, brak jest danych na temat allogenicznych przeszczepów rogówki u zwierząt.
W medycynie ludzkiej obecnie wykorzystuje się szereg metod i technik keratoplastyki. Ze względu na technikę operacji przeszczepy rogówki można podzielić na przeszczepy drążące i warstwowe. Przeszczepy rogówki drążące to takie, w których wymienia się fragment rogówki pełnej grubości. W przeszczepach warstwowych rogówki wymianie ulega tylko powierzchowna część rogówki (nabłonek, jego błona podstawna, przednia warstwa istoty właściwej) lub też tylko głęboka jej część tylna (warstwa zrębu, błona Descemeta, śródbłonek) , (5).
a)  b)
b)  c)
c) 
Ryc. 2. Rodzaje przeszczepów rogówki: a) drążący; b) warstwowy powierzchowny; c) warstwowy głęboki;
W wyborze techniki zabiegu uwzględnia się wielkość przeszczepu a zależy ona od rozległości zmian rogówkowych. Najczęściej wielkość płata rogówki wynosi 6 – 8 mm. Rozmiar wycinanego otworu w rogówce biorcy musi być o 0,1 – 0,5 mm mniejszy. Istnieje zależność pomiędzy wielkością przeszczepu a jego czasem przeżycia. Im przeszczep ma większą powierzchnię tym więcej występuje komplikacji i powikłań (7).
W gałce ocznej, w celu utrzymania homeostazy i minimalizowania potencjalnych uszkodzeń, rozwinięty jest mechanizm określany terminem uprzywilejowania immunologicznego (immune privilege) (8). Miejsce uprzywilejowane immunologicznie to taka część ciała, do której wszczepienie tkanki nieuprzywilejowanej immunologicznie nie wywołuje typowej reakcji odrzucania. Natomiast tkanka uprzywilejowana immunologicznie to taka tkanka, która wszczepiona do tkanki nieuprzywilejowanej immunologicznie przeżywa o wiele dłużej niż tkanka nieuprzywilejowana immunologicznie. Zjawisko to tłumaczy się czynnikami takimi jak; istnienie bariery krew-oko, brakiem naczyń krwionośnych i chłonnych w rogówce, nieobecnością klasycznych komórek prezentujących antygen (APC) w centralnej części rogówki, czynnikami hamującymi w komorze przedniej oraz zjawiskiem immunologicznej odmienności komory przedniej (anterior chamber –associated immune deviation, ACAID), (6, 7, 8). Uprzywilejowane immunologicznie w gałce ocznej są miejsca oraz tkanki (7). Miejsca immunologicznie uprzywilejowane to: centralna cześć rogówka, komora przednia, ciało szkliste oraz przestrzeń podsiatkówkowa. Tkanki o statusie uprzywilejowania to: centralna część rogówki, soczewka, nabłonek barwnikowy siatkówki oraz fragmenty siatkówki. W świetle współczesnej wiedzy, stworzono nowe koncepcje, dotyczące zjawiska tolerancji immunologicznej oka. Jedną z nich jest teoria o braku „prawdziwej” tolerancji w stosunku do ocznych antygenów (6). Równocześnie stwierdzono, że fizjologicznie komórki rogówki na swojej powierzchni posiadają molekuły Fas –L (CD95L). Rola tych molekuł polega na wzmocnieniu apoptozy komórek T efektorowych. Obecne na śródbłonku rogówki cząsteczki CD59 i CD 46, skutecznie hamują efektorową funkcję dopełniacza. W ten sposób działają cytoprotekcyjnie na komórki śródbłonka, zapobiegając ich niszczeniu. Udokumentowane jest, że w centralnej części rogówki występuje niska ekspresja cząsteczek MHC klasy I i klasy II. Dodatkowo antygeny te, w tym obszarze, mają niską aktywność. Prawdopodobnie ich niska aktywność związana jest z obecnością IFNγ. Ponadto wszystkie warstwy rogówki wydzielają TGF β . Jest to cytokina o charakterze immunosupresyjnym. Keratocyty obecne w rogówce, w sposób stały, produkują receptory antagonistyczne dla IL-1. Wszystkie te czynniki sprzyjają wytworzeniu wyższej tolerancji na alloprzeszczep. Przeszczep rogówki, a zwłaszcza przeszczep drążący, ma połączenie z komorą przednią oka i płynem w niej obecnym. W ten sposób część antygenów dawcy przenika do układu odpornościowego biorcy. Komórki APC obecne w płynie śródgałkowym wiążą antygeny przeszczepu i poprzez kąt przesączania transportują go do krwi, zaś z krwią do śledziony (7, 8).
Wraz ze wzrostem liczby wykonanych przeszczepów rogówki wykazano, że rola uprzywilejowania immunologicznego w gałce ocznej nie jest tak istotna jak pierwotnie przypuszczano. Okazało się, że w naturalnych warunkach, bez zastosowania jakiejkolwiek immunosupresji, aż 80% przeszczepów w ciągu 3-6 miesięcy zostaje odrzucona (9). W pewnych stanach patologicznych, gdzie dochodzi do unaczynienia rogówki, ryzyko odrzucenia przeszczepu jest znacznie wyższe w porównaniu z transplantacją w ”normalną”, nieunaczynioną rogówkę. Około 50% wszystkich odrzutów przeszczepu występuje w ciągu pierwszych 6 miesięcy po operacji. Odrzucenie przeszczepu może dotyczyć nabłonka lub śródbłonka (5). W przypadku odrzucenia nabłonka powstają w nim liniowe zmętnienia. Następnie pojawiają się liczne, małe nacieki podnabłonkowe, którym może towarzyszyć zapalenie tęczówki. Intensywna miejscowa steroidoterapia zwykle powoduje regresję niekorzystnych objawów. W wielu ośrodkach, żeby zapobiec reakcji odrzucania nabłonka, nabłonek ten usuwa się z rogówki przed jej przeszczepem (6). Jednak groźniejszą formą odrzucania przeszczepu jest reakcja odrzucania śródbłonkowego, gdyż śródbłonek ten pełni ważną funkcję w utrzymaniu przejrzystości rogówki (7). W takich sytuacjach potrzebne jest leczenie immunosupresyjne. W tym celu podaje się w postaci kropli do worka spojówkowego glikokortykosteroidy oraz maści antybiotykowe. W przypadku podwyższonego ryzyka odrzucenia przeszczepu oprócz antybiotyków i glikokortykosteroidów podawanych miejscowo stosuje się je ogólnie. Również ogólnie podaje się małe dawki cyclosporyny. Miejscowe podawanie cyclosporyny po operacji keratoplastyki okazało się nieskuteczne (5, 7). O powodzeniu przeszczepu mówi się wtedy, gdy przeszczepiona rogówka pozostaje przezierna i prawidłowej grubości przez co najmniej rok (7). Odrzut przeszczepu jest złożonym procesem immunologicznym, który w konsekwencji prowadzi do zniszczenia rogówki. Część pacjentów z rozpoznaniem choroby przeszczepu udaje się całkowicie wyleczyć, podczas gdy niektórzy przechodzą chorobę przeszczepu wielokrotnie, co prowadzi do dekompensacji i odrzucenia materiału, mimo stosowania identycznych strategii terapeutycznych. Analiza przeżycia przeszczepu pokazuje, że punktem newralgicznym jest osiemnasty miesiąc po operacji (10). W celu przedłużenia przeżycia przeszczepu wdraża się nowe techniki operacyjne przeszczepiania rogówek np. zastosowanie techniki DALK – (deep anterior lamellar keratoplsty) polegającej na przeszczepie najbardziej zewnętrznej warstwy nabłonka i zrębu rogówki (11) czy też wykorzystanie techniki DSEK (descement – stripping endothelial keratoplasty), która polega na wszczepieniu biorcy wyizolowanej błony Descemeta, pokrytej komórkami śródbłonka (12). Podjęto nawet próby wykorzystania komórek macierzystych do odtworzenia warstw rogówki (13).
Niestety, nieustannie brakuje dawców, wobec czego próbuje się stworzyć sztuczne rogówki. Historia sztucznej rogówki sięga osiemnastego wieku. Początkowo rogówkę próbowano zastąpić szkłem, potem wprowadzono protezy oparte na materiałach biologicznych i syntetycznych (14, 15). Rogówki biosyntetyczne stworzono na bazie kolagenu. Syntetyzowane są in vitro i wszczepiane pacjentom. Kolagen takiej rogówki stopniowo jest unerwiany i kolonizowany przez komórki pacjenta. Korzystnym faktem jest to, że biosyntetyczna rogówka nie stymuluje reakcji odrzucenia przeszczepu (15). Keratoprotezy to sztuczne implanty rogówkowe stosowane u pacjentów nie kwalifikujących się do allogenicznej keratoplastyki.
KERATOPLASTYKA W PRAKTYCE WETERYNARYJNEJ
W praktyce weterynaryjnej głównym problemem jest brak dawców. Nie istnieją Banki Tkanek Oka a brak regulacji prawnych, etycznych i medycznych powoduje niemożność określenia kryteriów dotyczących dawcy. Zwykle chorobowo zmieniona rogówka, psa czy też kota, nie kwalifikuje się do alloprzeszczepu, gdyż należy do grupy wysokiego ryzyka odrzucenia (7). Wynika to z faktu, ze rogówki objęte zaawansowanym procesem chorobowym są najczęściej głęboko unaczynione. Dodatkowo występuje w nich silny naciek komórek zapalnych. Zwykle są też pogrubione i ulegają pigmentacji. Wszystkie te czynniki powodują, że alloprzeszczepy u tych zwierząt są mało skuteczne (16). W takich sytuacjach rozwiązaniem może być zastosowanie implantów (16, 17).

Ryc. 3. Przygotowanie miejsca pod protezę w rogówce oka.
W 2008 roku Dr Sinisa Grozdanic z USA wykorzystała prototyp implantu rogówki do przywrócenia wzroku swojemu psu Dixie (16). Prototyp implantu został przygotowany w firmie Acrivet. Była to plastikowa keratoproteza, którą wszczepiono w nieprzezierną rogówkę biorcy. Najpierw w rogówce biorcy przygotowano łoże dla implantu a następnie umieszczono w nim keratoprotezę. Całość umocowano szwami i przykryto płatem spojówkowym. Po kilku tygodniach, gdy rana uległa wygojeniu, w spojówce nad implantem wycięto otwór tak, aby odsłonić sztuczną rogówkę. Niestety, otwór był mały i jakość widzenia pacjenta była nieporównywalna ze zdrowym okiem. Implant jednak pozwalał widzieć małe fragmenty obrazu.
Kolejnym doniesieniem, opisującym wykorzystanie protezy u psów, jest praca naukowa wykonana przez dr Ingrid Allgoewer (17). Prototyp protezy wykonany był z silikonu również przez firmę Acrivet (KP). Silikonowa KP składa się z dwóch części, gdzie część środkowa, optyczna o średnicy 6 mm otoczona jest częścią chropowatą o promieniu 3 mm. Taką protezę umieszczono w zrębie rogówki, starając się ulokować ją jak najbliżej błony Descemeta. W tym celu w rogówce biorcy, za pomocą trefiny o średnicy 6 mm wykonano keratektomię warstwową tak, żeby nie uszkodzić błony Descemeta. Następnie, ostrzem lamelarnym, na całym obwodzie wykonanego otworu, w zrębie rogówki wycięto kieszonkę o głębokości 3 mm. (Patrz rycina 3).
Ryc. 4. Schemat rogówki oka z umieszczoną protezą.
Kieszonka ta służyła do zakotwiczenia protezy. Po umieszczeniu protezy w tak wykonanym otworze, przykryto ją poprzednio wyciętym płatem rogówki. Płat ustabilizowano szwami 9-0. Następnie, w tym przyszytym płacie rogówki centralnie nad częścią optyczną, wycięto otwór o średnicy 3 mm tak, żeby jego krawędzie nachylone były pod kątem 45 o. (Patrz rycina 4).
Po zabiegu na 14 dni wykonano tymczasowe zespolenie powiek. Autorzy pracy, po wnikliwej analizie wykonanych przeszczepów uważają, że ten typ KP nie może być niestety rekomendowany do użycia w klinice. Potrzebne są dalsze badania w celu udoskonalenia techniki przeszczepu i samej protezy (17).
Podsumowując, można stwierdzić, że keratoplastyka u psów ma na razie niską skuteczność. Prawdopodobnie wynika to z faktu współistnienia w gałce ocznej lub w aparacie ochronnym oka stanów zapalnych, które negatywnie wpływają na długość przeżycia implantu (16). Dodatkowo utrzymanie higieny protezy wszczepionej w rogówkę nastręcza szereg problemów, ponieważ nierówna powierzchnia rogówki i protezy sprzyja gromadzeniu się w tym obszarze wszelkich zanieczyszczeń (17).
Sztuczne rogówki, opracowane wiele lat temu i ciągle udoskonalane są coraz częściej wykorzystywane w chirurgii okulistycznej (15). Jednak ich wykorzystanie w praktyce weterynaryjnej jest ciągle ograniczone. Ulepszenie biomateriałów oraz modyfikacja technik chirurgicznych może wkrótce rozszerzyć zakres zastosowania takich rogówek.
Dr n. wet. Przemysław K. Bryła
e-mail: brylapik@wp.pl
PIŚMIENNICTWO:
- Miller P.E.: W: Cornea. W: Essentials of veterinary ophtalmology, Wydane przez Gelatt K. , Blackwell Publishing 2000, s. 34-78
- Maggs D. J.: Rogówka i twardówka, W: Okulistyka weterynaryjna Slattera, Wydane przez Maggs D.J., Miller P.E., Ofri R., Saunders Elseviere, Wrocław, 2009, s. 192-223.
- Samuelson D. A. : Ophtalmic Anatomy, W: Veterinary ophthalmology, Wydane przez Gelatt K., Blackwell Publishing , Wydanie IV, 2007, s. 37-60
- Grahn B. H., Peiffer R. L.: Fundamentals of Veterinary Ophtalmic Pathology. W: Veterinary Ophtalmology, Wydane przez Gelatt K., Blackwell Publishing, Wydanie IV, 2007, s. 355-437
- Kański J. J. : Rogówka. W: Okulistyka Kliniczna. Drugie Wydanie Polskie, Wydawnictwo Medyczne Górnicki , 2007, s. 96-142
- Kański J. J., Kubicka-Trząska A.: Autoimmunologiczne choroby narządu wzroku. Wydawnictwo Medyczne Górnicki, 2005, s. 1-8.
- Biros D. J. : Ocular Immunity. W: Fundations of Clinical Ophtalmology. Section II, Wydane przez Gelatt K., Blackwell Publishing , 2007, s. 223-231.
- Szaflik J, Izdebska J. Przeszczepy rogówki. Przewodnik Lekarza . 2003, 6, 6, 69-72.
- Górecki A., Romaniuk A.: Immunologia transplantacyjna, W: Immunologia, Wydane przez Jakóbisiak M., PWN, Wydanie II, 1996, s. 621-622.
- Thompson R. W. Jr,, Prince M. O., Bowers P. J. et al.: Long-term graft survival after penetrating keratoplasty. Ophtalmology, 110 1396-1402.
- Feizi S., Javadi M. A., Jamali H., Mirbabaee F. : Deep anterior corneal keratoplasty in patients with keratoconus – big bubble technique. Cornea, 2010, 177-182.
- Dapena I., Ham L., Melles G. R. : Endothelial keratoplasty: DSEK/DSAEK or DMEK – the thiner the better? Curr Opin Ophtalmol. 2009, 20, 299-307.
- Hongshan L., Yianhua Z., Chia –Yang L. et al. : Cell therapy of congenital corneal diseases with umbilical mesenchymal stem cells: Lumican Null Mice. Plos ONE 5 (5) e 10707.
- Vega F., Millan M. S., Wells B. : Spherical lens versus aspheric artificial cornea for intraocular testing. Optics Letters, 2010, 35, 1539-1541.
- Ngakeng V., Hauck M. J., Price M. O., Price F. W. : Alfacor keratoprosthesis: a novel approach to minimize the risik of long-term postoperative complications. Cornea 2008, 27, 905-910.
- Science News. First Veterinary Corneal Implant Procedure in U. S. Performed On Dog. Science News 2008, May,www.sciencedaily.com.
- Allgoewer I., McLellan G. J., Agarwal S. : A keratoprosthesis prototype for the dog. Veterinary Ophtalmology, 2010, 13, 47-52. doi: 10.1111/J
LECZENIE CHIRURGICZNE WYPADNIĘCIA GRUCZOŁU TRZECIEJ POWIEKI U PSA
„CHERRY EYE”
Przemysław K. Bryła
Powieka trzecia jest to fałd spojówki leżący w kącie przyśrodkowym oka. W fałdzie tym znajduje się chrząstka, która ma postać płytki w kształcie litery T. Na tej chrząstce od strony gałki ocznej leży gruczoł trzeciej powieki. U psa ma on kolor lekko czerwony; rolą jego jest produkcja wodnej komponenty łez. Przyjmuje się, że odpowiada on za 30 – 35% produkcji łez w danym oku (1,2). Gruczoł trzeciej powieki przymocowany jest do tkanki łącznej twardych struktur oczodołu za pomocą więzadeł, które utrzymują go w obrębie trzeciej powieki. W przypadku , gdy więzadła te są słabo wykształcone lub ulegają aplazji ( wada wrodzona lub nabyta ), dochodzi do przemieszczania się gruczołu ponad trzecią powiekę (2). Wypadnięcie gruczołu trzeciej powieki określane jest terminem „ cherry eye „. Niektóre rasy psów i kotów szczególnie często narażone są na tę dolegliwość. Spośród psów wymienić należy psy rasy Cocker Spaniel, Beagle, Shith Tzu, Bokser a wśród kotów , koty Birmańskie (1,3). „ Cherry eye” dotyczy zwykle młodych zwierząt do szóstego miesiąca życia i występuje jedno lub obustronnie (4).
Dolegliwość ta powinna być leczona, ponieważ długotrwałe uwięźnięcie gruczołu prowadzi do jego uszkodzenia i w efekcie do osłabienia funkcji. Zmniejszenie produkcji łez jest obarczone ryzykiem powstania w późniejszym okresie życia psa syndromu „ suchego oka „ (4, 5).
Znanych jest kilka metod chirurgicznego leczenia „cherry eye” : począwszy od manualnego odprowadzenia gruczołu na swoje miejsce – co jest możliwe tylko we wczesnym okresie po wypadnięciu, poprzez całkowite lub częściowe jego odjęcie – obarczone ryzykiem powstania „suchego oka „ (6), aż do chirurgicznego odprowadzenia gruczołu pod spojówkę trzeciej powieki. Tę ostatnią metodę opracował Morgan i znana jest pod nazwą „pocket technique”- technika kieszonki (1). Pozwala ona na odprowadzenie gruczołu w całości pod spojówkę z zachowaniem jego funkcji.
Metodę tę zdecydowaliśmy się zastosować w leczeniu „cherry eye” u psa, który trafił do naszej przychodni. Pacjentem był 20 tygodniowy bokser płci żeńskiej.

Ryc. 1. Cherry eye.
Badaniem okulistycznym zdiagnozowano wypadnięcie gruczołu trzeciej powieki wraz z odkształceniem podstawy chrząstki trzeciej powieki. Wykonano, test łzowy Schirmera – Schirmer Tear Test (Schering Plough Animal Health), barwienie rogówki fluoresceiną – Fluoretest ( Chauvin Pharmaceuticals Ltd.) oraz pomiar ciśnienia śródgałkowego tonometrem aplanacyjnym. Badanie oka nie wykazało innych zmian chorobowych. Przed zabiegiem wykonano badanie kliniczne, EKG i analizę krwi. Ich wyniki nie odbiegały od normy. Zabieg wykonano w znieczuleniu ogólnym. Do zabiegu użyto narzędzi okulistycznych.
Etap pierwszy polegał na przecięciu zagiętej chrząstki trzeciej powieki. Najpierw nacięto spojówkę powiekową, a następnie chrząstkę. Przecięcie chrząstki miało za zadanie poprawić przyleganie trzeciej powieki do gałki ocznej.
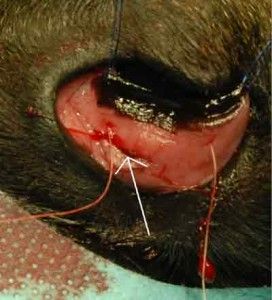
Ryc. 2. Linia cięcia chrząstki trzeciej powieki.
Następnie wywinięto trzecią powiekę tak, żeby gruczoł leżał na powiece. Bezpośrednio przed i za wystającym gruczołem nacięto spojówkę gałkową. Oba cięcia nie mogą się ze sobą łączyć.
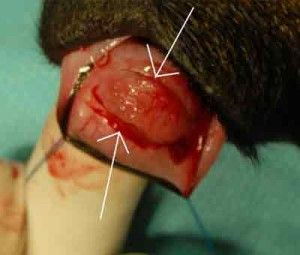
Ryc. 3. Linia cięć spojówki przed i za gruczołem łzowym trzeciej powieki.
Nożyczkami okulistycznymi wycięto pod spojówką gałkową trzeciej powieki „kieszonkę” – „pocket”. Za wrota kieszonki służyła nam przecięta spojówka za gruczołem. Za pomocą nici chirurgicznej 6.0 vicryl złączono szwem ciągłym brzegi przeciętej przed i za gruczołem spojówki, aby w ten sposób przykryć go spojówką. Szycie rozpoczęto i zakończono od strony powiekowej trzeciej powieki aby powstały węzeł nie drażnił rogówki.
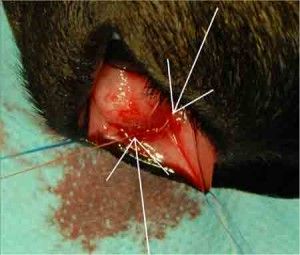
Ryc. 4. Prowadzenie szwu łączącego brzegi spojówki. Wypadnięty gruczoł stopniowo przykrywany był spojówką.
Następnym krokiem było delikatne wprowadzenie gruczołu do wyciętej kieszonki i zawiązanie szwu.
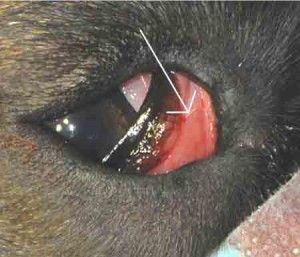
Ryc. 5. Węzeł szwu na powiekowej powierzchni trzeciej powieki. Oko bezpośrednio po operacji.
Przez kilka dni po zabiegu do oka wkraplano antybiotyk , a pies musiał nosić kołnierz ochronny. Po kilku dobach od operacji oko wróciło do normalnego funkcjonowania.
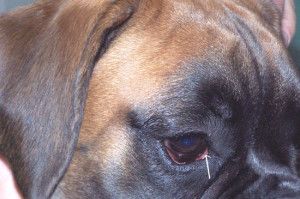
Ryc. 6. Oko 10 – go dnia po zabiegu. Widoczny węzeł szwu.
PIŚMIENNICTWO
- Morgan R.V., Duddy I.M., McClurg K. – Prolapse of the gland of the third eyelid in dogs: a retrospective study of 89 cases. J. of the Am. Animal Hosp. Ass..1993, 29, 56.
- Miller P. E. – w Essentials of Veterinary Ophtalmology pod red. K. Gelatt. 2000. 113
- Chahony S. I ,Crasta M., Trio St., Clerc B. – Three cases of prolapse of the nicticans gland in cats. Vet. Opht..2004, 7 (2),113.
- Dugan S.J., Severin G.A., Hungerford L.L. – Clinical and histological evaluation of the prolapsed third eyelid gland in dogs. J. of the Am. Vet. Med. Ass.. 1992, 15, 201, 1861
- Saito A., Watanabe I., Kotani T. – Morphologic changes of the anterior corneal epithelium caused by third eyelid removal in dogs. Vet. Opht. 2004, 7 ,113.
- Kaswan R. L., Martin C. L. – Surgical correction of the third eyelid prolapse in dogs. J. of the Am. Vet. Med. Assotiation. 1985, 186 (1), 83.
SUCHE ZAPALENIE SPOJÓWEK I ROGÓWKI U PSA, KERATOCONJUNCTIVITIS SICCA (KCS)
ZESPÓŁ SUCHEGO OKA
Przemysław K. Bryła
NARZĄD ŁZOWY PSA.
Narząd łzowy (apparatus lacrimalis) psa składa się z gruczołów łzowych oraz dróg odprowadzających łzy. W skład gruczołów łzowych psa ( gl. lacrimalis) wchodzą; główny gruczoł łzowy, odpowiadający za produkcję 70 – 80 % objętości łez oraz dodatkowy gruczoł łzowy powieki trzeciej, produkujący od 20 do 30 % ich objętości. Główny gruczoł łzowy leży wewnątrz oczodołu w dole gruczołu łzowego, w bocznej części powieki górnej pod spojówką, natomiast gruczoł łzowy powieki trzeciej znajduje się na chrząstce powieki trzeciej. Od gruczołów łzowych odchodzą przewodziki odprowadzające (ductuli excretorii), które otwierają się do worka spojówkowego (1). Gruczoły łzowe mają budowę pęcherzykowo-cewkową. Części wydzielnicze gruczołów łzowych składają się z komórek sześciennych otoczonych komórkami mioepitelialnymi. W cytoplazmie komórek wydzielniczych obserwuje się liczne pęcherzyki wydzielnicze (2). Gruczoły łzowe produkują łzy (lacrime) , które są przezroczystą , lekko opalizującą cieczą. Łzy produkowane są stale, przy czym można zaobserwować dobową rytmikę ich wydzielania np. w trakcie snu produkcja łez ulega zmniejszeniu.. Również wraz z wiekiem wydzielanie łez obniża się (3). Wydzielanie łez można podzielić na podstawowe (spoczynkowe) i bardziej obfite (odruchowe). Wydzielanie łez odruchowe pojawia się w odpowiedzi na czuciowe podrażnienie rogówki i spojówki. Natomiast po podaniu do oka kropli ze środkiem znieczulającym produkcja łez maleje (4). Na powierzchni oka łzy tworzą przedrogówkowy film łzowy, który u psa ma grubość ok. 7 u. Składa się on z trzech warstw: lipidowej, wodnistej i śluzowej (5). Każda z tych warstw pełni odrębne funkcje. Zewnętrzna warstwa lipidowa produkowana jest przez gruczoły Meiboma. Warstwa ta hamuje odparowywanie wodnistej komponenty filmu łzowego. Poprzez zwiększenie napięcia powierzchownego filmu łzowego, zatrzymuje w nim wodę oraz natłuszcza powieki. Środkową warstwą przedrogówkowego filmu łzowego jest warstwa wodnista. Produkowana jest przez gruczoły łzowe. Warstwa ta oprócz wody zawiera białka, cukier i elektrolity. Rola jej polega na dostarczaniu tlenu i substancji odżywczych do beznaczyniowego nabłonka rogówki. Dzięki obecności we łzach immunoglobulin i enzymów działa również przeciwbakteryjnie. Poza tym usuwa z powierzchni oka materiały resztkowe i szkodliwe. Dzięki tej warstwie ułatwiony jest również napływ leukocytów do miejsca urazu. Ostatnią warstwę filmu łzowego stanowi wewnętrzna warstwa śluzowa. Produkowana jest przez komórki kubkowe spojówki. Powstały śluz zwilża i natłuszcza rogówkę. Dzieje się tak na skutek przekształcenia hydrofobowej powierzchni nabłonka rogówki w hydrofilną (4,5,6). 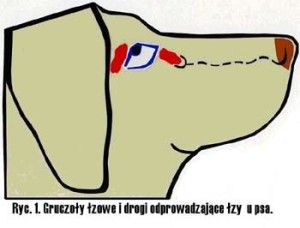 Film łzowy rozprowadzany jest po powierzchni oka w sposób mechaniczny, dzięki neurologicznie kontrolowanemu odruchowi mrugania. Nadmiar filmu łzowego usuwany jest przez drogi odprowadzające łzy. Za skuteczne rozprowadzenie filmu łzowego po powierzchni rogówki odpowiedzialne są również; prawidłowy nabłonek rogówki i dopasowanie powierzchni oka do powierzchni powiek (6). Po spełnieniu swojej funkcji łzy gromadzą się w części worka spojówkowego, która sąsiaduje bezpośrednio z kątem przyśrodkowym oka, a następnie trafiają do dróg odprowadzających. Najpierw do jeziorka łzowego (lacus lacrimalis), skąd dzięki siłom włoskowatości, grawitacji i pracy mięśni okrężnych oka zasysane są przez punkty łzowe (punctum lacrimale) do kanalika łzowego (canaliculus lacrimalis), który wpada do woreczka łzowego (saccus lacrimalis). Z woreczka łzowego łzy trafiają do przewodu nosowo-łzowego (ductus nasolacrimalis). Przewód ten u psa zwykle kończy się na granicy przedsionka jamy nosowej ujściem nosowo-łzowym (ostium nasolacrimale; 1). Drogi odprowadzające łzy mają ściany zbudowane z tkanki łącznej właściwej luźnej pokrytej nabłonkiem wielowarstwowym. Bliżej jamy nosowej nabłonek ten jest urzęsiony (2).
Film łzowy rozprowadzany jest po powierzchni oka w sposób mechaniczny, dzięki neurologicznie kontrolowanemu odruchowi mrugania. Nadmiar filmu łzowego usuwany jest przez drogi odprowadzające łzy. Za skuteczne rozprowadzenie filmu łzowego po powierzchni rogówki odpowiedzialne są również; prawidłowy nabłonek rogówki i dopasowanie powierzchni oka do powierzchni powiek (6). Po spełnieniu swojej funkcji łzy gromadzą się w części worka spojówkowego, która sąsiaduje bezpośrednio z kątem przyśrodkowym oka, a następnie trafiają do dróg odprowadzających. Najpierw do jeziorka łzowego (lacus lacrimalis), skąd dzięki siłom włoskowatości, grawitacji i pracy mięśni okrężnych oka zasysane są przez punkty łzowe (punctum lacrimale) do kanalika łzowego (canaliculus lacrimalis), który wpada do woreczka łzowego (saccus lacrimalis). Z woreczka łzowego łzy trafiają do przewodu nosowo-łzowego (ductus nasolacrimalis). Przewód ten u psa zwykle kończy się na granicy przedsionka jamy nosowej ujściem nosowo-łzowym (ostium nasolacrimale; 1). Drogi odprowadzające łzy mają ściany zbudowane z tkanki łącznej właściwej luźnej pokrytej nabłonkiem wielowarstwowym. Bliżej jamy nosowej nabłonek ten jest urzęsiony (2).
PRZYCZYNY I OBJAWY KLINICZNE „SUCHEGO OKA”.
Określenie „suche zapalenie spojówek i rogówki” i „suche oko” są synonimami. Wyróżnia się dwa typy tego schorzenia: pierwszy spowodowany niedoborem łez oraz drugi wywołany nadmiernym wyparowywaniem łez, przy czym te dwa typy nie wykluczają się wzajemnie (4).
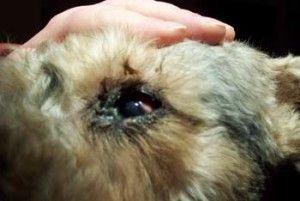
Suche zapalenie spojówek i rogówki spowodowane niedoborem łez ma u psa głównie tło autoimmunologiczne. Układ odpornościowy w tym przypadku rozpoznaje własne komórki wydzielnicze gruczołów łzowych jako obce i zaczyna je niszczyć. W wyniku tego procesu dochodzi do spadku produkcji łez. Proces destrukcji komórek wydzielających łzy zależny jest od receptorów obecnych na tych komórkach, a kluczową rolę pełnią w nim cytokiny. Niektóre rasy psów szczególnie są predysponowane do tego typu reakcji. Wymienić tu należy; amerykańskie i angielskie cocker spaniele, sznaucery miniaturowe, west highland white teriery, pudle i jamniki miniaturowe, pekińczyki, shih tzu oraz psy rasy york terier (7). Kolejną przyczyną „suchego oka” może być wrodzony, dziedziczony z rodziców na potomstwo, brak lub niedorozwój gruczołów łzowych. Problem ten często spotyka się u psów rasy york terier (8). Udowodniono, że niektóre leki z grupy sulfonamidów i aspiryna, wpływają hamująco na produkcję łez. Spadek produkcji łez może mieć w tym przypadku charakter czasowy lub trwały (9). Również przebyte choroby zakaźne tj. u psa nosówka, a u kota herpeswiroza uszkadzają komórki wydzielające łzy, co sprzyja powstaniu suchego zapalenia spojówek i rogówki (8). U psów, które mają zaburzenia w gospodarce hormonalnej, również może dochodzić do powstania „suchego oka”. Często problem ten stwierdza się przy niedoczynności tarczycy, cukrzycy oraz nadczynności przytarczyc (10). Ponadto syndromowi „suchego oka” powodowanemu niedoborem łez sprzyja zniszczenie tkanki gruczołów łzowych poprzez nowotwory, długotrwałe stany zapalne, urazy, zabiegi chirurgiczne oraz blizny (4). Suche zapalenie spojówek i rogówki, wywołane nadmiernym wyparowywaniem łez, zwykle powodowane jest brakiem warstwy lipidowej i nieprawidłowym rozprowadzeniem filmu łzowego. Brak warstwy lipidowej najczęściej powstaje wtórnie do niedrożności gruczołów Meiboma , a nieprawidłowe rozprowadzenie filmu łzowego jest wynikiem niewłaściwego dopasowania powieka – oko lub zaburzenia odruchu mrugania (4). W przypadku, gdy trudno jest ustalić przyczynę powstania „suchego oka”, mówimy wówczas o idiopatycznej naturze choroby. Oko pozbawione wystarczającej ilości łez staje się „zadrażnione”. Choroba prowadzi do wysuszenia powierzchni spojówek i rogówki. Spojówki ulegają przekrwieniu, a następnie tworzy się stan zapalny. Na rogówce pojawiają się pasma śluzu, a później ropy. Nadmiar śluzu, który zbiera się na dolnej powiece, wysychając przyjmuje postać strupów. W miarę trwania choroby pojawiają się keratopatie. Najpierw są to punktowe ubytki nabłonka rogówki, które obejmują jej dolną część. Ubytkom tym mogą towarzyszyć filamenty pasm śluzu przyczepione jednym końcem do powierzchni rogówki. Wolne ich końce natomiast poruszają się z każdym mrugnięciem powiek. W suchym oku śluz wraz z zanieczyszczającymi go lipidami gromadzi się w filmie łzowym., a obecna w nim mucyna ma tendencję do szybkiego wysychania. Na powierzchni rogówki oprócz filamentów śluzu spotyka się płytki śluzowe. Są to białawe i biało-szare, różnej wielkości i kształtu zmiany zbudowane ze śluzu, komórek nabłonka i substancji białkowo-lipidowych. Zmiany te barwią się różem Bengalskim. W miarę trwania choroby, suche oko jest stanem predysponującym do rozwoju bakteryjnego zapalenia rogówki i powstania owrzodzenia, które może prowadzić do perforacji rogówki. Rzadszymi objawami „suchego zapalenia spojówek i rogówki” są; świąd, światłowstręt, bolesność przy mruganiu. Objawy choroby nasilają się w wyniku działania czynników sprzyjających wyparowywaniu łez tj. wiatr, wentylacja, centralne ogrzewanie, klimatyzacja (3,4,5,6,7,8,9,10).
ROZPOZNANIE KCS
Pomimo charakterystycznych objawów klinicznych, przed postawieniem prawidłowej diagnozy, niezbędne jest przeprowadzenie badania pozwalającego określić stopień produkcji łez w danym oku. Pomiar ten wykonuje się za pomocą testu, określanego terminem testu łzowego Schirmera – STT. Test ten oparty jest na pomiarze długości zwilżenia specjalnej bibułki w jednostce czasu 60 s. Można go przeprowadzić po podaniu środka znieczulającego miejscowo oko lub bez niego. Teoretycznie, test przeprowadzony bez środka znieczulającego (STT-1) określa całkowite wydzielanie łez, natomiast wykonany po podaniu środka znieczulającego (STT-2) bada tylko wydzielanie podstawowe. W praktyce okazuje się jednak, że krople znieczulające miejscowo zmniejszają ilość łez wydzielanych odruchowo, ale nie eliminują go całkowicie (4,5). Test STT-1 przeprowadza się w następujący sposób: oko należy delikatnie osuszyć. Pasek bibułki np. Schirmer Tear Test – Schering-Plough Animal Health, zagiąć w odległości ok. 5 mm od początku naniesionej na bibułkę skali. Tak przygotowaną bibułkę należy umieścić w dolnym załamku oka, na granicy pomiędzy 1/3 środkową i boczną częścią powieki, uważając by nie dotknąć rogówki. Pies powinien mieć oczy otwarte i zachować normalny odruch mrugania. Po 60 s. bibułkę należy wyjąć i na podanej skali milimetrowej odczytać dystans jaki pokonały łzy. Dla ułatwienia odczytu w/w bibułka posiada niebieski znacznik, który dyfunduje wraz ze łzami po wyrażonej w milimetrach skali. Ryc. 3.
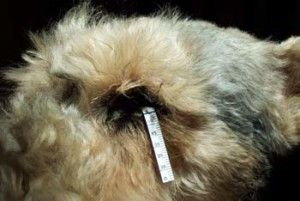
Test STT-2 przeprowadza się w podobny sposób z tym, że 5 minut przed badaniem wydzielania łez, należy wkroplić do badanego oka 1 lub 2 krople środka miejscowo znieczulającego np. Alcaine 5mg/ml – Alcon-Couvreur (5). W przypadku testu STT-1, gdy łzy zamoczą mniej niż 10 mm bibułki możemy stwierdzić, że pies cierpi na suche zapalenie spojówek i rogówki. Gdy uzyskany na bibułce wynik zawiera się w granicach 10 – 15 mm, wówczas w zależności od obserwowanych objawów klinicznych mamy do czynienia lub nie z „suchym okiem”. U takich osobników badanie powinno być powtórzone po upływie 1 miesiąca. Wynik powyżej 15 mm pozwala stwierdzić, że w badanym oku produkcja i wydzielanie łez jest na prawidłowym poziomie (5,11,12). Za pomocą testu łzowego STT-2 uzyskuje się wyniki stanowiące ok. 30 -50 % wartości wyników uzyskanych w teście STT-1 (13). Kolejnym testem pomocnym w diagnostyce „suchego oka” jest test określający czas przerwania filmu łzowego (Break Up Time – BUT). Wskaźnik ten określa stabilność przedrogówkowego filmu łzowego. Badanie wykonuje się za pomocą lampy szczelinowej w szerokiej szczelinie z filtrem kobaltowym po uprzednim zapuszczeniu fluoresceiny do dolnego załamka oka. Czas przerwania filmu łzowego mierzy się od ostatniego mrugnięcia do pojawienia się pierwszej, przypadkowo rozmieszczonej suchej plamy na rogówce. BUT krótszy niż 10 s. jest nieprawidłowy (4). Innym, pomocnym, ale rzadko wykonywanym u psów testem w diagnostyce KCS jest barwienie powierzchni oka różem Bengalskim. Dzięki zastosowaniu tego barwnika łatwiej uwidaczniają się filamenty rogówkowe i płytki śluzowe (4)
LECZENIE KCS
Leczenie suchego zapalenia spojówek i rogówki ma na celu zmniejszenie dyskomfortu, utrzymanie gładkiej powierzchni optycznej oraz zapobieganie uszkodzeniom rogówki. Postępowanie lecznicze uzależnione jest od przyczyny powodującej KCS. Przede wszystkim należy leczyć schorzenia podstawowe tj. niedoczynność tarczycy, cukrzycę, nadczynność przytarczyc. Leczenie „suchego oka” polega na stosowaniu jednocześnie kilku środków medycznych; są to preparaty zastępujące łzy oraz leki stymulujące ich produkcję. Istnieje wiele preparatów, które są substytutami łez. Występują one w postaci; kropli (hipromeloza, alkohol poliwinylowy, sól sodowa kwasu hialuronowego, poliwidion), żeli (związki karbomerowe) oraz maści (olej mineralny). Największą niedogodnością stosowania kropli jest ich krótki okres działania. Poza tym środki użyte do konserwacji kropli mogą być przyczyną reakcji alergicznych. W celu uniknięcia reakcji nadwrażliwości można stosować krople, które nie zawierają środków konserwujących np. Tears Naturale Free – Alcon. Krople należy stosować bardzo często, nawet co 2 – 3 godziny. Żele wystarczy nanosić na powierzchnię oka w odstępach 4 – 6 godzinnych. Na noc najlepiej jest zastosować maść (4,5,6). Postępowanie lecznicze radykalnie zmieniło się po wprowadzeniu do leczenia cyclosporyny (14). Cyklosporyna jest lekiem, który wykazuje silne działanie immunosupresyjne. Wpływa na proces aktywacji limfocytów T, głównie na komórki pomocnicze CD 4, a w mniejszym stopniu na limfocyty B. Cyklosporyna nie hamuje migracji leukocytów ani proliferacji limfocytów T stymulowanej cytokinami. Działanie jej jest cytostatyczne (15). Cyklosporynę stosuje się miejscowo, zwykle dwa razy dziennie, w postaci maści np. Optimune 0,2% – Schering-Plough lub kropli 0,05 – 0,5 %. Pierwsze korzystne efekty stosowania cyklosporyny zauważalne są dopiero po 3 – 4 tygodniach jej stosowania. W przypadku, gdy po tym okresie nie ma uchwytnej poprawy w produkcji łez, należy zwiększyć częstotliwość jej podawania do trzech razy na dobę. Zadawalające wyniki uzyskuje się, gdy leczenie jest długotrwałe, prowadzone niekiedy do końca życia zwierzęcia. Miejscowe, długotrwałe podawanie cyklosporyny nie wywiera na organizm niekorzystnego wpływu (14,15). Alternatywnym lekiem dla cyklosporyny, który przejawia podobnie silne właściwości przeciwzapalne i immunomodulacyjne jest takrolimus – Prograf 5mg/ml – Astellas. Takrolimus jest lekiem immunosupresyjnym z grupy makrolidów. W komórce łączy się on ze swoistym białkiem, zapobiegając w ten sposób transkrypcji genów limfokin. Lek hamuje również powstawanie limfocytów cytotoksycznych, aktywację komórek T , proliferację limfocytów B oraz ekspresję receptora IL-2. U psów stosuje się go miejscowo, dwa razy na dobę, w postaci 0,02% kropli. Uzyskuje się podobny efekt leczniczy jak w przypadku stosowania cyklosporyny (16). Innym lekiem, obecnie rzadko stosowanym w leczeniu „suchego oka”, jest pilokarpina. Pilokarpina jest alkaloidem o działaniu parasympatykomimetycznym. Jako środek cholinergiczny, kontroluje funkcje wydzielania łez przez komórki gruczołu łzowego. Pilokarpinę można stosować miejscowo do oka. W przypadku , gdy wystąpią objawy uboczne ze strony układu pokarmowego lub krążenia, należy zaniechać jej podawania. Pilokarpina jest skutecznym lekiem w leczeniu KCS tylko wówczas, gdy przyczyną jego jest uszkodzenie unerwienia odpowiedzialnego za sekrecję łez w gruczołach łzowych (4,11). Obecnie trwają poszukiwania kolejnych preparatów, które można by wykorzystać w leczeniu suchego zapalenia rogówki i spojówek u psów. Lekiem, w którym upatruje się przyszłość, może być czynnik wzrostu komórek nerwowych- Nerv Growth Factor – NGF. Wykazano, że stosowanie go u psów pozbawionych gruczołów łzowych powieki trzeciej, znacznie zwiększało tworzenie łez. NGF stosowany był miejscowo w postaci maści nanoszonej dwa razy na dobę (17). W przypadku, gdy leczenie farmakologiczne nie przynosi pożądanych efektów, stosuje się zabieg chirurgiczny. U psów można wykonać transpozycję przewodu ślinianki przyuszniczej z jamy ustnej do worka spojówkowego. W ten sposób ślina zastępuje łzy. Ponieważ ślina wydzielana jest na skutek stymulacji pokarmem, takie psy powinny być często karmione. Ślina nie jest idealnym preparatem łzozastępczym. Zawiera w swoim składzie dużo związków mineralnych, które mogą wytrącać się wokół oka w postaci kryształków (11). Innym sposobem na poprawienie wilgotności oka jest czasowe lub trwałe zamknięcie punktów łzowych. W tym celu do kanalików łzowych wprowadza się zatyczki. Zatyczki mogą być kolagenowe lub silikonowe. Głównym celem czasowego zamknięcia jest upewnienie się, czy po trwałym zamknięciu nie dojdzie do nadmiernego łzawienia. Do długotrwałego zablokowania kanalików łzowych służą zatyczki silikonowe (4).
PIŚMIENNICTWO
- Kobryń H., Kobryńczuk F.: Anatomia zwierząt, tom 3. Wydawnictwo Naukowe PWN, Warszawa 2004.
- Sawicki W.: Histologia. Wydawnictwo Lekarskie PZWL, 3 wyd., 2000.
- Hartley C.,Williams D. L., Adams V. J.: Effect of age, gender, weight, and time of day on tear production in normal dogs. Vet. Ophthalmol., 2006, 9, 1, s. 53-57.
- Kański J. J.: Okulistyka kliniczna. Górnicki Wydawnictwo Medyczne, 2 wyd., Wrocław 2005.
- Alkan F., Izei C., Tepeli C., Koc Y.: Evaluation of the Schirmer Tear Test in clinically normal Turkish hunting dogs (Turkish Greyhound). Vlaamas Dirgeneeskundig Tijdschrift. 2004, 73, s. 269 – 273.
- Severing G. A. : Lacrimal Apparatus.: W: Veterinary Ophthalmology Notes. Severin G. A. (edit.), 2 wyd., Colorado Stat University, Fort Colins, 1986, s. 117 – 134.
- Izci C., Celik I., Alkan F., Ogurtan Z., Ceylan C., Sur E., Ozkan Y. : Histological characteristics and local cellular immunity of the gland of the third eyelid after topical ophthalmic administration of 2% cyclosporine for treatment of dogs with keratoconjunctivitis sicca. Am. J. Vet. Res., 2002, 63, s. 688 – 694.
- Slater D.: Lacrimal System.: W: Fundamentals of Veterinary Ophthalmology. Slatter D. H. (edit.), 2 wyd., W. B. Sanders Company, Philadelphia 1990, s. 237 – 256.
- Wilkie D. A., Wolf E. D. : Sulfonamides and keratoconjunctivitis sicca. J Am. Vet. Med. Assoc., 1990, 196, 4, s. 521 – 522.
- Wiliams D. L., Pierce V., Mellor P., Heath M. F. : Reduced tear production in three canine endocrinopathies. J. Small Anim. Pract., 2007, 8, April.
- Miller-Smith Sonja J. : Keratoconjunctivitis Sicca. Darwin Vet. Ctr. Ld. 2007. Materiały pozyskane z internetu, http://www.darwinvets.com.
- Hamor R. E., Roberts S. M., Severin G. A., Chavkin M. J. : Evaluation of results for Schirmer tear test conducted with and without application of a topical anesthetic in clinically normal dogs of 5 breeds. Am. J. Vet. Res., 2000, 61, s. 1422 – 1425.
- Saito A., Kotani T.: Estimation of lacrimal level and testing methods on normal beagles. Vet. Ophthalmol., 2001, 4, s. 7 – 11.
- Tang-Liu D. S., Acheampong A.: Ocular pharmacokinetics and safety of ciclosporin, a novel topical treatment for dry eye. Clin. Pharmacokinet., 2005, 44, 3, s. 247 261.
- Madany J., Wiśniewska M. : Cyklosporyna – jej właściwości i zastosowanie w okulistyce małych zwierząt. Annales Universitas Marie Curie-Skłodowska, 2005, LX, 5, s. 30 – 34.
- Berdoulay A., English R. V., Nadelstein B. : Effect of topical 0,02% tacrolimus aqueous suspension on tear production in dogs with keratoconjunctivitis sicca. Vet. Ophthalmol., 2005, 8, 4, s. 225 – 232.
- Coassin M., Lambiase A., Costa N., De Gregorio A., Sqrulletta R., Sacchetti M., Aloe L., Bouini S. : Efficacy of topical NGF treatment in dogs affected by dry eye. Ciraetes Arch. Clin. Exp. Ophthalmol., 2005, 243, 2, s. 151 – 155.
J A S K R A
Przemysław K. Bryła
WYTWARZANIE I ODPŁYW CIECZY WODNISTEJ.
Przednia i tylna komora oka wypełnione są przezroczystym płynem, zwanym cieczą wodnistą. Ciecz ta zawiera minimalne ilości białka i lipidów, zjonizowane elektrony i jony organiczne, glukozę, aminokwasy oraz układy enzymatyczne w ilościach zbliżonych do stężeń osocza krwi. Stałość składu chemicznego i właściwości fizycznych cieczy wodnistej zapewnia bariera komorowo – naczyniowa. Podłożem strukturalnym tej bariery jest śródbłonek naczyń włosowatych tęczówki i nabłonek ciała rzęskowego, które jest rodzajem gruczołu rozpościerającym się jak kryza wokół tylnej komory oka (1). Składa się ono z części przedniej – sfałdowanej i z części tylnej – płaskiej. Część sfałdowana zbudowana jest z promieniście ułożonych wyrostków, skierowanych w stronę tylnej komory oka, pokrytych nabłonkiem barwnikowym i niepigmentowym. Każdy z tych wyrostków ma centralnie przebiegającą tętniczkę, która kończy się bogatą siecią włośniczkową. Ścisłe połączenia pomiędzy sąsiadującymi komórkami warstwy pozbawionej barwnika stanowią barierę krew – ciecz wodnista (2).

w wyniku procesu metabolicznego, który zależy od działania wielu układów enzymatycznych, zwłaszcza od pompy ATP-azy sodowo-potasowej. W procesie tym znaczną rolę odgrywa enzym anhydraza węglanowa. W skutek różnicy ciśnień osmotycznych w oku, dochodzi również do biernego przepływ płynu, ale proces ten u zwierząt odgrywa minimalną rolę w produkcji cieczy wodnistej, stanowiąc u kota 3% objętości cieczy wodnistej, a u psa 15%. Wielkość produkcji cieczy wodnistej u psa wynosi około 1-2 ul/min, a u kota około 14-20 ul/min (3,4). Prawdopodobnie z wiekiem wielkość produkcji cieczy wodnistej maleje (3). Krążenie krwi w błonie naczyniowej oka oraz wydzielanie cieczy śródocznych i ich prawidłowy przepływ zapewnia odpowiednie ciśnienie we wnętrzu gałki ocznej. Odpowiednio wysokie ciśnienie wewnątrzgałkowe konieczne jest do utrzymania optycznej krzywizny rogówki, gładkości jej powierzchni i stałego współczynnika załamania (1). Ciecz wodnista wypełniając przednią część oka odgrywa ważną rolę w stosunku do soczewki i rogówki. Elementy optyczne oka nie mają własnych naczyń krwionośnych, a rolę zaopatrzenia w tlen i składniki odżywcze s pełnia tu ciecz wodnista (4). Ciśnienie śródoczne zależy od równowagi pomiędzy objętością tworzonego płynu, a jego odpływem. U psa za prawidłowe ciśnienie wewnątrz gałki ocznej przyjęto wartości poniżej 25 mmHg, a u kota poniżej 31 mmHg (5,6). Wartości te zależą między innymi od rasy, płci i wieku zwierzęcia jak również od metody pomiaru, doświadczenia osoby badającej. Pomiar ciśnienia śródgałkowego wykonuje się za pomocą tonometrów. Tonometria jest obiektywnym pomiarem ciśnienia polegającym na wywieraniu znacznej siły, koniecznej do spłaszczenia lub wgłobienia rogówki. Znanych jest kilka rodzajów tonometrów, które mają zastosowanie w okulistyce weterynaryjnej. Najpopularniejszym, ponieważ najtańszym w zakupie i utrzymaniu, jest tonometr Schiotza wyposażony w tłoczek o odpowiedniej masie, powodujący wgłobienie rogówki (7). Wielkość wgłobienia odczytywana jest na skali i za pomocą odpowiednich tabel konwertujących, ciśnienie śródoczne odczytujemy w mmHg. Innym, a zarazem mniej uciążliwym dla badanego zwierzęcia i dla badającego, jest Tono-pen – ręczny, kontaktowy tonometr zasilany przez baterie. Końcówka Tono-penu zawiera przetwornik, który mierzy zastosowaną siłę potrzebną do spłaszczenia rogówki. Mikroprocesor analizuje krzywą ilorazu zastosowanej siły i czasu. Wartość ciśnienia podawana jest na skali w mmHg (6). Wadą obu wyżej wymienionych tonometrów jest konieczność znieczulenia rogówki oka przed pomiarem ciśnienia. Z punktu widzenia lekarza weterynarii, idealnym tonometrem jest Tonovet. Zasada działania urządzenia oparta jest na indukcyjnej metodzie pomiaru siły odbicia od rogówki bardzo lekkiej sondy. Metoda ta umożliwia szybki i dokładny pomiar ciśnienia wewnątrzocznego bez stosowania środków znieczulających. Stosowanie jednorazowych sond eliminuje prawdopodobieństwo zakażeń. Pomiar wykonywany jest z ręki w ułamkach sekundy. Przyrząd ten zaprogramowany jest na serię sześciu pomiarów. Wynik pomiaru podawany jest w mmHg (8). Urządzenie to nie wymaga tak częstych kalibracji, jak w przypadku Tonopenu.

Krążenie cieczy wodnistej w oku oparte jest głównie na zasadzie grawitacji i konwekcji. Ruchy głowy oraz różnice temperatur pomiędzy rogówką a wnętrzem oka wywierają duży wpływ na jej krążenie. Nieznaczną rolę pełni tu również transport aktywny (2). Ciecz wodnista z komory tylnej oka, poprzez otwór źreniczny, przepływa do przedniej komory oka, aby dalej poprzez kąt przesączania ujść do zatoki żylnej twardówki (5). Taki sposób odpływu cieczy wodnistej nazywany jest drogą konwencjonalną; jest to główna droga , którą odpływa około 90% cieczy wodnistej. Pozostałe 10% odpływa drogą naczyniówkowo-twardówkową, zwaną niekonwencjonalną i polega na przepływie cieczy przez ciało rzęskowe do przestrzeni nadnaczynówkowej i drenowaniu jej przez krążenie żylne w ciele rzęskowym, naczyniówce i twardówce (2). Przestrzeń zawarta pomiędzy tylną obwodową powierzchnią rogówki a przednią nasadą tęczówki tworzy kąt przesączania, którego konfiguracja związana jest z patogenezą jaskry. Do badania i analizy kąta przesączania służy gonioskopia. Gonioskop to niewielki przyrząd optyczny nakładany po znieczuleniu oka bezpośrednio na rogówkę, umożliwia on identyfikację patologicznych struktur kąta i ocenę jego szerokości (9). Kąt przesączania tęczówkowo – rogówkowy składa się z więzadeł grzebieniastych (pectinate ligaments), szczelin rzęskowych (ciliary cleft), siateczki beleczkowej (trabecular meshwork) i kanałów odprowadzających ciecz wodnistą do żył zatoki żylnej twardówki. Więzadła grzebieniaste to różnych kształtów i rozmiarów wyrostki tęczówki, które penetrują obwodową rogówkę na granicy z twardówką. Pełnią one rolę filarów tkanki naczyniowej w kącie przesączania. Wysokość więzadeł grzebieniastych warunkuje stopień szerokości kąta przesączania. Im więzadła wyższe, tym kąt przesączania szerszy. Szerokość tego kąta jest istotna dla procesu odpływu cieczy wodnistej (10,11). Wolne przestrzenie w ciele rzęskowym zwane szczelinami, tworzą zachyłki, w których ma swój początek siateczka beleczkowa. Zbudowana jest ona z licznych warstw kolagenu i elastyny pokrytych płaskim śródbłonkiem. Siateczka beleczkowa pełni rolę filtru w kącie przesączania. Szczeliny zlewają się w kanały, które łącząc się ze sobą uchodzą do systemu żył oka (11). Ryc. 2.
PATOGENEZA I OBJAWY JASKRY
Jaskra to grupa chorób oczu, w których na skutek podwyższonego ciśnienia wewnątrzgałkowego dochodzi do upośledzenia procesu widzenia. W przypadku, gdy podwyższonemu ciśnieniu nie towarzyszy zaburzenie widzenia, mówimy o nadciśnieniu ocznym (12). Jaskra powstaje w wyniku zaburzonego odpływu cieczy wodnistej, przy równoczesnym procesie jej stałego wydzielania. Wzrost objętości cieczy wodnistej przekłada się na wzrost ciśnienia wewnątrzgałkowego. Zwiększone ciśnienie jest jednym z czynników, które prowadzi do niszczenia komórek zwojowych siatkówki i nerwu wzrokowego. Bezpośrednią przyczyną zmian wstecznych we włóknach nerwu jest utrudniony transport aksoplazmy Zniszczone komórki zwojowe uwalniają również glutaminian i inne substancje toksyczne, które uruchamiają apoptozę kolejnych komórek nerwowych (13). Proces ten jest proporcjonalny do wysokości ciśnienia śródocznego i czasu jego trwania. Ubytki włókien nerwowych w siatkówce mogą mieć charakter uogólniony lub miejscowy. W miarę postępu choroby uszkodzenia stają się większe, a w końcowym stadium prowadzą do całkowitego zaniku warstwy włókien nerwowych w siatkówce (2). Utrata komórek nerwowych następuje również w tarczy nerwu wzrokowego, co przejawia się zapadaniem jej powierzchni, demielinizacją i przybraniem szarej barwy. Na powierzchni tarczy nerwu wzrokowego tworzą się szczelinowate pory, a wokół niej, na skutek zaniku siatkówki, makatka odblaskowa „świeci” wyraźniej (14). Wzrost ciśnienia śródgałkowego mechanicznie rozciągając oko prowadzi do atrofii siatkówki i naczyniówki co sprzyja stagnacji krążenia, niedotlenieniu i uwalnianiu neurotoksyn. Ponadto zaburzeniu ulega cyrkulacja składników odżywczych i odbieranie produktów przemiany materii z komór oka (15). Nerw wzrokowy odżywiany jest specjalną siecią naczyń krwionośnych. W przypadku gdy naczynia te są w części zamknięte lub zwężone, nie doprowadzają odpowiedniej ilości krwi do nerwu, co może prowadzić do zaniku włókien zwojowych i w konsekwencji powodować ślepotę. Dużą rolę w procesie niedokrwienia nerwu wzrokowego przypisuje się endotelinie (13). Zaobserwowano, że oko psa podatne jest bardziej na uszkodzenia powodowane wysokim ciśnieniem śródocznym w porównaniu do oka kota. U kota nawet długotrwające wysokie ciśnienie śródgałkowe nie powoduje ślepoty, a objawy kliniczne jaskry są słabiej wyrażone (16). W ostrej fazie jaskry ciśnienie wewnątrzgałkowe jest wysokie, nierzadko osiąga wartość 70 – 80 mmHg (15). Oko w takim stanie jest bolesne, co zwierzęta manifestują mrużeniem powiek, pocieraniem głową o przedmioty, czy też tarciem oka łapą. Obserwuje się nadmierne łzawienie, przekrwienie naczyń krwionośnych i obrzęk spojówek. Oko staje się „czerwone”. Zwierzęta tracą apetyt, są osowiałe, unikają światła i więcej śpią. W miarę postępu choroby gałka oczna powiększa się powodując woloocze. Na powiększonej gałce ocznej często nie domykają się powieki co zaburza pracę filmu łzowego i prowadzi do powstania licznych keratopatii. Na skutek obrzęku mętnieje powierzchnia rogówki i mogą pojawić się w niej mętne linie zwane liniami Haabs’a – są to wygojone pęknięcia błony Descemeta. Źrenice ulegają rozszerzeniu i zwykle słabo bądź wcale nie reagują na bodziec świetlny. Często obserwuje się anizoscorię – różne wielkości źrenic. W soczewce na skutek stagnacji krążenia tworzą się katarakty. Powiększenie objętości gałki ocznej narusza przyczepy soczewki, prowadząc do jej zwichnięcia lub przemieszczenia do komór oka. W wyniku zwiększonej przepuszczalności ścian naczyń włosowatych, do komór oka napływają cząsteczki białka, powodując zapalenie błony naczyniowej oka (uveitis) lub rzekome zapalenie błony naczyniowej oka (pseudouveitis). Zmiany charakterystyczne dla jaskry występują zazwyczaj w jednym oku, ale nie jest wykluczone występowanie ich równocześnie lub z pewnym opóźnieniem w obu oczach. Jaskra jest chorobą nieuleczalną i postępującą, która niszcząc nerw wzrokowy prowadzi do nieodwracalnej ślepoty (11,15,17,18,19,20).
RODZAJE JASKRY
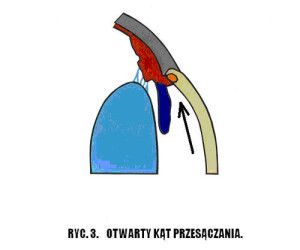
objawy kliniczne i leczenie różnych typów jaskry są różne, nie ma jednej definicji, która odpowiednio określałaby wszystkie jej odmiany, jednak ogólnie jaskrę podzielić możemy na pierwotną i wtórną. Określenie jaskra pierwotna oznacza, że przyczyna, która powoduje utrudniony odpływ cieczy wodnistej z oka nie jest wynikiem żadnej innej choroby oka. Taki rodzaj jaskry przekazywany jest z rodziców na potomstwo. Rozwija się w obu oczach, choć najczęściej niesymetrycznie; proces chorobowy zajmuje najpierw jedno oko, a następnie drugie. Jaskra wtórna jest postacią jaskry powodowaną inną chorobą oczu np. uraz, zapalenie, nowotwór lub chorobami ogólnymi, w przebiegu których wytwarza się w oku znacznie podwyższone ciśnienie śródgałkowe, powodujące uszkodzenie nerwu wzrokowego. Charakterystyczną cechą tej postaci jaskry jest występowanie zmian zazwyczaj w jednym oku. W praktyce klinicznej stosuje się również podział anatomiczny wynikający z budowy kąta przesączania. Wyróżniamy tu jaskrę z szerokim, otwartym kątem i jaskrę z wąskim, zamykającym się kątem przesączania. Oceny budowy kąta przesączania dokonuje się za pomocą gonioskopu (9). U zwierząt domowych takich; jak pies, kot, najczęściej mamy do czynienia z jaskrą wtórną z wąskim lub szerokim kątem przesączania (5,15,16,19,20). W jaskrze pierwotnej z szerokim, otwartym kątem przesączania, gdzie komora przednia oka jest głęboka, podwyższenie ciśnienia w oku powodowane jest zablokowaniem dróg odpływu cieczy wodnistej poprzez siateczkę beleczkową. Ten typ jaskry często występuje u psów rasy beagle (4,16). Przyczyna jej jest nieznana. Pojawia się we wczesnym okresie życia. Charakteryzuje ją powolny przebieg i niewielki wzrost ciśnienia śródgałkowego, o około 5 –10 mmHg (4). Stopniowo prowadzi do utraty wzroku. W siateczce beleczkowej oka tych psów stwierdzono zwiększone wytwarzanie glikoaminoglikanów,cieczy wodnistej (16,17,21).
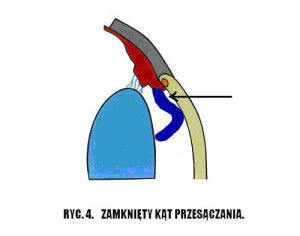
Często tę formę jaskry określa się jako jaskrę pierwotną otwartego kąta bez goniodysgenezy. Goniodysgeneza jest to wrodzona dysplazja elementów wchodzących w skład budowy kąta przesączania (22). Inną formą jaskry pierwotnej otwartego kąta jest jaskra związana z goniodysgenezą. Rozwija się ona powoli i ujawnia około 3 – 6 roku życia psa. Słabo wykształcone więzadła grzebieniaste, siateczka beleczkowa i szczeliny rzęskowe utrudniają drenaż cieczy wodnistej. W takim kącie przesączania dochodzi do nadprodukcji substancji podobnej do substancji wchodzącej w skład błony Descemeta. Substancja ta fizycznie „zatyka” filtr jakim jest utkanie beleczkowe (18,22). Tę postać choroby najczęściej spotyka się u psów ras północnych, baset houndów, cocker spanieli i bouvierów de flandres (18, 23). W takim oku ciśnienie śródgałkowe podwyższa się powoli, nie dając objawów bólowych, ale prowadzi do zniszczenia nerwu. W jaskrze pierwotnej z wąskim, zamykającym się kątem przesączania, gdzie komora przednia oka jest płytka, dojście do utkania beleczkowego jest utrudnione przez tęczówkę. Wrodzona gruba, mięsista tęczówka zasłania kąt przesączania. Chorobie sprzyja uwypuklona do przedniej komory oka duża, okrągła soczewka (16). Rozszerzenie źrenicy może powodować dalsze blokowanie tego kąta, prowadząc do powstania ostrego napadu jaskrowego, kiedy to ciśnienie śródgałkowe wzrasta do 70 – 80 mmHg. Przy tak wysokich wartościach nerw wzrokowy może zostać nieodwracalnie uszkodzony w ciągu kilku dni. Z taką formą jaskry często mamy do czynienia u psów rasy samojed, u których powstaje tak zwany blok źreniczny – zwiększony opór dla przepływu cieczy wodnistej przez źrenicę (24,25,26). Jaskrę wtórną można zdefiniować jako jaskrę spowodowaną inną pierwotną chorobą oka, w przebiegu której, lub w skutek której, powstaje wysokie ciśnienie wewnątrzoczne niszczące nerw wzrokowy. Również i w tym przypadku wyróżniamy jaskrę otwartego i zamkniętego kąta przesączania. Jaskra wtórna otwartego kąta wynika z patologii w obrębie utkania beleczkowego i dalszych dróg odpływu cieczy z oka. Najbardziej typowymi postaciami tej jaskry są : jaskra związana z uwalnianiem białek z przejrzałej soczewki (fakolityczna); jaskra barwnikowa, w przebiegu której drobiny melaniny uwolnione z tęczówki blokują odpływ w kącie przesączania; jaskra torebkowa, złuszczone komórki z torebki soczewki zatykają kąt przesączania; hemolityczna po wylewie krwi do oka; jaskra po urazach oka oraz jaskra polekowa. Tę ostatnią postać spotyka się po długotrwałym stosowaniu leków sterydowych. Dochodzi wówczas do zmiany struktury siateczki beleczkowej. Niekiedy jaskra rozwija się jako następstwo przebytej operacji oka, co może wynikać z uszkodzenia struktur oka i powstania blizn oraz zrostów. Ponadto w przebiegu zapaleń błony naczyniowej oka mogą tworzyć się zmiany bliznowate w rejonie kąta przesączania, prowadząc do jaskry (2,16,27,28). Jaskra wtórna zamkniętego kąta wynika ze zmian w obrębie kąta przesączania, które w sposób mechaniczny utrudniają prawidłowy dostęp cieczy wodnistej do siateczki beleczkowej (16,27). Przeszkodę tę mogą stanowić; patologiczna nasada tęczówki, guzy, nieprawidłowe naczynia, zrosty powstające w obrębie źrenicy, bądź zmiany związane z soczewką. Wyróżnić możemy tu dwie postaci jaskry: jaskrę fakotopiczną – wynikającą z przemieszczenia soczewki i jaskrę fakomorfotyczną powodowaną nieprawidłowym kształtem soczewki i jej pęcznieniem w przebiegu zaćmy (27,28).
LECZENIE JASKRY
Celem leczenia jaskry jest utrzymanie funkcji widzenia na możliwie najlepszym poziomie. Lecząc jaskrę mamy możliwość wpływania tylko na ciśnienie panujące wewnątrz oka. Dla każdego zajętego przez jaskrę oka istnieje indywidualny poziom ciśnienia, który jest bezpieczny. Ten bezpieczny poziom ciśnienia nazywany jest ciśnieniem docelowym, które może się zmieniać w ciągu życia. Można je osiągnąć stosując leki zmniejszające produkcję cieczy wodnistej oraz leki ułatwiające jej odprowadzanie z oka. W przypadku braku zahamowania choroby leczeniem farmakologicznym, należy zastosować zabiegi laserowe lub chirurgiczne zmniejszające produkcję cieczy wodnistej lub ułatwiające jej odpływ do przestrzeni podspojówkowej. Niestety, zwierzęta bardzo często trafiają do lekarzy weterynarii z tak zaawansowaną postacią jaskry, że pozostaje do wykonania tylko zabieg enukleacji lub ewisceracji. W przypadku napadu jaskrowego dobre wyniki uzyskuje się poprzez dożylne podanie 20% mannitolu w dawce 1 – 2 mg/kg wagi ciała. Kurację można powtórzyć po 6 godzinach. Innym lekiem hyperosmotycznym jest 50% glicerol. Podaje się go doustnie w dawce 1 – 2 mg/kg wagi ciała . Jeżeli zachodzi taka konieczność terapię można powtórzyć po 8 godzinach (29). Równocześnie należy zastosować leczenie farmakologiczne w kroplach podawanych bezpośrednio na powierzchnię oka (15,16). Obecnie stosuje się cztery grupy leków; są to: betablokery, inhibitory anhydrazy węglanowej, miotyki i analogi prostaglandyn (16,30,31,32,33). Betablokery zmniejszają produkcję cieczy wodnistej; w Polsce występują pod nazwami np. Cosopt, Fotil, Timoptic, stosować należy je 2- razy na dobę. Przy przedawkowaniu mogą zaostrzać- szczególnie u kotów – objawy astmy oskrzelowej. Inhibitory anhydrazy węglanowej również zmniejszają produkcję cieczy wodnistej, ale dodatkowo też rozszerzają naczynia krwionośne w tkankach oka, co redukuje niedokrwienie w jaskrze. W Polsce dostępne są np. 2% Trusopt i 1% Azopt. Stosuje się je po jednej kropli 3 – razy dziennie. Inhibitory anhydrazy węglanowej dostępne są też w postaci tabletek np. Diuramid 250 mg. Podawać go należy w ilości 10 – 25 mg/kg wagi ciała na dobę, w 2 – 3 dawkach. Ubocznym efektem ich stosowania może być kwasica metaboliczna. Do grupy miotyków zaliczamy pilokarpinę. Jest to najstarszy lek przeciwjaskrowy, obniżający ciśnienie w oku poprzez ułatwianie odpływu cieczy wodnistej wskutek skurczu mięśniówki ciałka rzęskowego. Występuje pod postacią 1% lub 2 % kropli. Pilokarpinę należy stosować co 6 godzin. Przy długotrwałym podawaniu powstają trwałe zmiany w oku w postaci zrostów. Nie należy stosować jej w oku z zapaleniem błony naczyniowej oraz przy przemieszczeniu soczewki do przedniej komory oka. Lekami przeciwjaskrowymi nowej generacji są analogi prostaglandyn (30), które silnie obniżają ciśnienie śródoczne otwierając dodatkowe drogi odpływu cieczy wodnistej z przedniej komory oka (droga naczyniówkowo-twardówkowe). W Polsce dostępne są pod nazwami np.; Xalatan, Lumigan, Travatan; u zwierząt stosuje się je po 1 kropli jeden, dwa razy dziennie (32). W przypadku gdy możliwości leczenia farmakologicznego zostaną wyczerpane, należy rozważyć zabieg operacyjny: laserowy lub chirurgiczny (16,19,20,33). Wszystkie zabiegi operacyjne mają na celu obniżenie ciśnienia w oku. Laserem można wykonać trabekuloplastykę – otwarcie przymknietych otworków filtracyjnych w jaskrze otwartego kąta – oraz irydotomię, zabieg stosowany w jaskrze z wąskim kątem przesączania. Światłem laserowym wykonuje się mały otworek w tęczówce, który pozwala na przepływ cieczy wodnistej z tylnej komory oka do przedniej. Gdy wszystkie sposoby obniżenia ciśnienia zawodzą, można wykonać zabieg zniszczenia części ciałka rzęskowego produkującego ciecz wodnistą. Dokonać tego można za pomocą YAG lasera (cyklokoagulacja), metodą krioterapii (cyklokrioterapia) lub za pomocą substancji farmakologicznej (16,34,35,36). Metoda ta polega na dogałkowym podaniu mieszaniny gentamycyny i dexamethasonu, po uprzednim usunięciu części cieczy wodnistej. Obecnie w tym samym celu stosuje się leki przeciwwirusowe np. Cidofovir (33). Metody tej można użyć w przypadku trwale ślepego oka, w którym nie stwierdza się aktywnego procesu zapalenia ani obecności nowotworu. U kotów metody tej nie stosuje się. Kolejnym sposobem leczenia jaskry u psów jest założenie w oku gonioimplantów (34). Ułatwiają one odprowadzanie z oka nadmiaru cieczy do przestrzeni podspojówkowej. Metoda ta ma jednak małe znaczenie praktyczne, ponieważ wytrącający się w implantach włóknik szybko je zatyka. Radykalną metodą postępowania w przypadku nie leczonej i zaniedbanej jaskry, w której doszło do nieodwracalnej ślepoty, jest zabieg wypatroszenia oczodołu (15,16). Zabieg jest łatwy do wykonania i szybko przynosi ulgę cierpiącemu zwierzęciu. Odmianą tego zabiegu jest ewisceracja (33). Polega ona na wprowadzeniu do wnętrza oka silikonowej protezy, po uprzednim usunięciu jego wewnętrznych zawartości. Protezy oka dostępne są w trzech rozmiarach. Przy pomocy ostrza skalpela można je dopasować do kształtu gałki ocznej. Za pomocą tej techniki uzyskuje się dobry efekt kosmetyczny. Ewisceracja nie jest polecana do stosowania u kotów.
PIŚMIENNICTWO
- Bernat R.: Zmysł wzroku. W: Fizjologia człowieka z elementami fizjologii klinicznej. Traczyk W., Trzebski A. (edit.) PZWL, 1980, s.109-110.
- Kański J.J. – Okulistyka Kliniczna, Górnicki Wydawnictwo Medyczne, 2 wyd., Wrocław 2005, s. 192-269.
- Peiffer Jr R.L., Gellat K.N., Gum G.G.: Determination of the facility of aqueous humor outflow in the dog, comparing in vivo and in vitro tonographic and constant pressure perfusion technique. Am. J. Vet. Res. 1976, 37, s.1473-1477.
- Barrie K.P., Gum G.G., Samuelson D.A., Gellat K.N.: Quantitation of uveoscleral outflow in normotensive and glaucomatous Beagels by 3-H labeled dextran. Am. J. Vet. Res. 1985, 46, s.84-88.
- Bedford P.G.C., Grierson I.: Aqueous drainage in the dog. Res. Vet. Sci. 1986, 41, s.172-186.
- Miller P.E., Pickett J.P., Majors U.: In vivo and in vitro comparison of Mackay-Marg and Tono-pen applanation tonometers in dogs and cats. The nineteenth annual scientific program of the American College of Veterinary Ophtalmologists. Las Vegas, Nevada, 1988. Materiał pozyskany z internetu.
- Peiffer Jr. R.L., Gelatt K.N., Jessen C.R., Gum G.G., Gwin R.M., Davis J.: Calibration of the Schiotz tonometer for the normal canine eye. Am. J. Vet. Res. 1977, 38, s.1881-1889.
- TonoVet – Instrukcja obsługi i konserwacji. Przychodnia weterynaryjna w Warszawie, ul Hawajska 16. Materiał własny.
- Martin C.L.: Gonioscopy and anatomical correlations of the drainage angle in the dog. J. Small Anim. Pract. 1969, 10, s.171-184.
- Barrie K.P., Gum G.G., Samuelson D.A., Gelatt K.N.: Morphologic studies of uveoscleral outflow in normotensive and glaucomatous Beagles with fluorescein-labeled dextran. Am. J. Vet. Res. 1985, 46, 1, s. 89-97.
- Whiteman A.L.: Morphologic and immunohistochemical features of canine acute primary angle closure glaucoma. Invest. Ophtalmol. Vis. Sci. 2000, 41, s. 516-521.
- Miller P.E., Pickett J.P., Majors U.: The efficacy of topical prophylactic antiglaucoma therapy in primary closed angle glaucoma in dogs; a multicenter clinical trials. J. Am. Hosp. Assoc. 2000, 36, s. 431-443.
- Brooks D.E.: Vitreous body glutamate concentration in dogs with glaucoma. Am. J. Vet. Res. 1997, 58, s. 864-867.
- Brooks D.E.: Histomorphometry of the optic nerves of normal dogs with hereditary glaucoma. Exp. Eye Res. 1995, 60, s. 71-76.
- Miller P.E.: Glaucoma.: W: Kirk’s Current Vet. Therapy XII Small Anim. Pract. Bonagura J.D. (Edit.) Sanders W.B., Philadelphia, 1995, s.1265-1272.
- Miller P.E.: Glaucoma; Diagnisis and Therapy. Waltham Symposium. Small Anim. Opht. 2001. Materiały pozyskane z internetu, www.vin.com.
- Gelatt K.N., Gum G.G.: Inheritance of primary glaucoma in the Beagel. Am. J. Vet. Res. 1981, 42, s.1691-1693.
- Smith R.I.E., Peiffer Jr. R.L., Wilcook B.P.: Some aspects of the pathology of canine glaucoma. Prog. Vet. Comp. Ophtalmol. 1993, 3 , s.16-18.
- Dietrich U.: Feline glaucomas. Clin. Tech. Small Anim. Pract. 2005, May, 20, 2, s.108-116.
- Brooks D.E.: Glaucoma in the dog and cat. Vet. Clin.North Am. Small Anim Pract. 1990, 20, 3, s.775-797.
- Gum G.G., Samuelson D.A., Galatt K.N.: Histochemical localization of GAG in the aqueous outflow pathways of normal beagels and beagels with inherited glaucomas. Prog. Vet. Comp. Ophtalmol.. 1993, 3, s.52-57.
- Kato K., Sasaki N., Matsunga S., Nishimura R., Ogawa H.: Incidence of canine glaucoma with goniodysplasia in Japan; a retrospective study. J. Vet. Med. Sci. 2006, 68, 8, s.853-853.
- Van der Linde-Sipman.: Dysplasia of the pectinate ligaments and primary glaucoma in the Bouvier de Flandres dog. Vet. Pathol. 1987, 24, s.201-206.
- Ekesten B., Torrang I.: Age-related changes in ocular distances in normal Samoyeds. Am. J. Vet. Res.1995, 56, s.127-133.
- Ekesten B., Torrang I.: Heritability of the depth of the opening of the ciliary cleft in Samoyeds. Am. J. Vet. Res. 1995, 56, s.1138-1143.
- Gelatt K.N., MacKay E.O.: Prevalance of the breed-related glaucoma in pure bred dogs in North America. Vet. Ophtalmol. 2004,7, 2, s. 97-111.
- Gelatt K.N., MacKay E.O.: Secondary glaucoma in the dog in North America. Vet. Ophtalmol. 2004, 7, 4, s. 243-259.
- Niżankowska M.H.: Jaskra. Przewodnik diagnostyki i terapii. Górnicki Wydawnictwo Medyczne. 2001, s.86-106, s.119-129.
- Lorimer D.W.: The effect of intravenous mannitol or oral glycerol on intraocular pressure in dogs. Cornell Vet. 1989, 79, s. 249-253.
- Gelatt K.N., MacKay E.O.: Changes in intraocular pressure associated with topical dorzolamide and oral methazolamide in glaucomatous dogs. Vet. Ophtalmol. 2001, 4, s.61-67.
- Wilkie D.A., Latimer C.A.: Effects of topical administration of timolol maleate on intraocular pressure and pupil size in dogs. Am. J. Vet. Res. 1991, 52, s.432-440.
- Studer M.E.: Effects of 0,005% latanoprost solution on intraocular pressure in healthy dogs and cats. Am. J. Vet. Res. 2000, 61, s.1220-1227.
- Brooks D.E.: Current concepts in veterinary ophthalmology. 2003. Materiały pozyskane z internetu, http://sacs.vetmed.ufl.edu.
- Bentley E.: Combinet cycloablation and gonioimplantation for treatment of glaucoma in dogs: 18 cases (1992-1998). J. Am. Vet. Med. Assoc. 1999, 215, s.1469-1473.
- Brightman A.H., Vestre W.A., Helper L.C., Tomes J.E.: Cryosurgery for the treatment of canine glaucoma. J. Am. Anim. Hosp. Assoc. 1982, 18, s.319-322.
- Sapienza I.S., Miller T.R., Gum G.G., Gelatt K.N.: Contact transscleral cyclophotocoagulation using a laser in normal dogs. Prog. Vet. Comp. Ophtalmol. 1992, 2, s.147-153.
WYBRANE SCHORZENIA SIATKÓWKI OKA PSA O PODŁOŻU GENETYCZNYM I NIE-ZAKAŹNYM
CHOROBY SIATKÓWKI
Przemysław K. Bryła
Siatkówka stanowi najbardziej wewnętrzną warstwę oka. Składa się z części barwnikowej (nabłonek barwnikowy siatkówki – RPE), zrastającej się ściśle z naczyniówką oka oraz z części neurosensorycznej. W części neurosensorycznej siatkówki występuje dziewięć identyfikowanych histologicznie warstw (1). Aksony komórek nerwowych siatkówki łączą się ze sobą tworząc nerw wzrokowy: u psa zawiera on około 167 tys. włókien nerwowych (2) oko ludzkie dla porównania zawiera około 1,2 mln (3). Nerw wzrokowy opuszcza oko w miejscu zwanym tarczą nerwu wzrokowego. W rozwoju zarodkowym nabłonek pigmentowy siatkówki powstaje z zewnętrznej warstwy komórek kielicha ocznego, podczas gdy część neurosensoryczna tworzona jest z jego warstwy wewnętrznej (3). Pochodzenie embrionalne w tym przypadku ma wpływ na stopień fizycznego połączenia obu warstw siatkówki. Miejscem predylekcyjnym dla odklejania się warstw siatkówki jest miejsce ich połączenia (2). Siatkówka psa posiada dwa rodzaje fotoreceptorów: czopki i pręciki. Pręciki stanowią większość i są odpowiedzialne za proces widzenia w słabym świetle, czopki natomiast służą do różnicowania kolorów i procesu widzenia w jasnym świetle (1).Większość fotoreceptorów zlokalizowana jest w centralnej części siatkówki w miejscu, gdzie brak jest naczyń, bezpośrednio nad tarczą nerwu wzrokowego (3). Gęstość fotoreceptorów w siatkówce psa w tym obszarze wynosi od 6,4 do 14,4 tys. komórek na 1mm kwadratowy (1), podczas gdy u człowieka od 50,0 do 160,0 tyś. komórek na 1 mm kwadratowy (3). Stosunkowo mała liczba czopków w siatkówce oka psa, bo stanowiąca jedynie ok. 10% wszystkich fotoreceptorów ma wpływ na proces widzenia kolorów. W siatkówce psa występują dwa rodzaje czopków: typ 1, wrażliwy na światło o długości fali fioletu i typ 2, wrażliwy na światło o długości fali żółtej (1). Powoduje to, że spektrum widzenia barw przez psa podzielone jest na dwa odcienie: niebiesko – fioletowy i żółty (3). Barwy takie jak: zielona, pomarańczowa, czerwona i ich odcienie nie są identyfikowane przez psa – oko psa widzi je jako różne odcienie szarości. Pies odróżnia o wiele więcej odcieni szarości niż człowiek (1). Światło padające na siatkówkę oka wywołuje w fotoreceptorach reakcje fotochemiczne, które prztwarzane są na impuls elektryczny biegnący włóknami nerwowymi do kory wzrokowej mózgu, dając w efekcie widzenie (2). Oglądając dno oka za pomocą oftalmoskopu widzimy dwa obszary anatomiczne: część jasną- świecącą (tapetum) i część ciemną (non-tapetum) (1,4). Część jasna położona jest dogrzbietowo i ma przeważnie kształt trójkąta, zaś część ciemna leży dobrzusznie i zajmuje pozostały obszar dna oka. Jasna część dna oka to makatka odblaskowa przeświecająca przez przezroczystą w tym miejscu warstwę barwnikową siatkówki. Przezroczystość siatkówki wynika z braku pigmentu w nabłonku pigmentowym siatkówki na tym obszarze (1,3,4). Makatka odblaskowa ma budowę komórkową i jest częścią naczyniówki oka. Decyduje ona o kolorze dna oka psa – od niebieskiego, zielonego poprzez żółty do brązowego. Istnieje zależność pomiędzy kolorem sierści psa , a kolorem dna oka. U zwierząt albinotycznych brak jest zabarwienia lub na dnie oka występują białe plamy (1). Rozmiar makatki odblaskowej uwarunkowany jest wielkością psa: im pies jest większy, tym większa jest jego makatka odblaskowa (4).
Funkcją makatki odblaskowej jest wzmocnienie sygnału świetlnego poprzez powtórzenie go na siatkówce. Istotne jest to u drapieżników w procesie widzenia w ciemności (5). W części ciemnej siatkówki (obszar non-tapetum) stężenie barwnika w nabłonku pigmentowym siatkówki jest tak duże, że leżąca pod nim naczyniówka staje się niewidoczna. Tarcza nerwu wzrokowego u psa zwykle znajduje się w części jasnej dna oka. Ma ona kształt owalny lub trójkątny, poprzez nią naczynia krwionośne wnikają i opuszczają dno oka. U psa są to zwykle trzy – cztery duże żyłki ułożone promieniście, którym towarzyszą liczne drobne tętniczki. Taki typ unaczynienia dna oka nazywany jest holangiotycznym (2). Siatkówka oka psa jest strukturą wysoce zróżnicowaną i złożoną. Tworzenie i funkcjonowanie siatkówki znajduje się pod nadzorem znacznej liczby genów. Potencjalne mutacje tych genów stają się przyczyną wielu chorób oka, które podlegają dziedziczeniu. Oprócz chorób wrodzonych siatkówkę uszkadzają czynniki zakaźne, niezakaźne, choroby tła immunologicznego, metaboliczne, nowotwory. Jedną z powszechnie występujących chorób siatkówki oka psa jest postępująca atrofia siatkówki (PRA – progressive retinal atrophy) , (5,7,8). Jest to grupa schorzeń o podłożu genetycznym stopniowo prowadząca do utraty wzroku i w efekcie do ślepoty. Choroba występuje w obu oczach równolegle a widoczne zmiany są symetryczne. Odnotowano ją u ponad stu ras psów (5). PRA przekazywana jest z rodziców na potomstwo w sposób autosomalny dominujący lub recesywny (6,7). Natomiast u psów rasy siberian husky i samojed gen PRA związany jest z chromosomem X (8). Postępująca atrofia siatkówki powodowana jest mutacjami genów odpowiedzialnych za fizjologiczne funkcje komórek fotoreceptorowych siatkówki. Rozkład i rodzaje mutacji u poszczególnych ras psów ulegają ciągłej modyfikacji (8). Ze względu na wiek psów, u których pojawiają się pierwsze symptomy PRA wyróżniono dwie formy choroby (7,9). W pierwszej z nich , formie wczesnej – dysplastycznej, pierwsze objawy notowane są u psów w 5-8 tygodniu życia. Ta forma PRA związana jest z nieprawidłowym rozwojem pręcików , a następnie również czopków w siatkówce. Występuje najczęściej u owczarków szkockich (rcd 1 – rod-cone dysplasia 1), seterów irlandzkich (rcd2), welsh corgi cardigan (rcd3) , (5,7). Druga forma PRA pojawia się u psów w późniejszym okresie ich życia, zwykle między czwartym a siódmym rokiem. W tej postaci postępującej atrofii siatkówki następuje zwyrodnienie i niszczenie komórek fotoreceptorowych (prcd – progressive rod cone degeneration). Forma ta najczęściej jest notowana u angielskich i amerykańskich cocker spanieli, labradorów, retriverów, toy pudli, owczarków belgijskich (5,7,10).
PRA jest grupą różnych genotypowo a podobnych fenotypowo schorzeń siatkówki. Pierwszym objawem zauważalnym przez właściciela jest utrata nocnego widzenia (nyctalpia). Pierwsze uszkodzeniu ulegają pręciki a dopiero później czopki (2). U psów z PRA obserwuje się rozszerzone źrenice, siatkówka staje się cienka a jej naczynia krwionośne tracą rozgałęzienia i zanikają. Poprzez taką cienką i ubogą w naczynia krwionośne siatkówkę silnie prześwieca makatka odblaskowa, dając wrażenie „świecenia oka” (1,5). Następnie tarcza nerwu wzrokowego ulega zwyrodnieniu (4). W zaawansowanym stadium PRA w oczach tworzą się katarakty. Ostateczne rozpoznanie choroby stawiane jest na podstawie badania elektroretinografem, które potwierdza zanik odpowiedzi fotoreceptorów na bodźce świetlne (3). Inną postacią zwyrodnienia siatkówki jest opisana u briarda, również w polskiej linii hodowlanej, kurza ślepota briardów (CSNB – congenital stationary night blindness), (11). Po zmroku zdolność widzenia u tych psów jest znacznie upośledzona. Choroba pojawia się u szczeniąt zwykle między piątym a ósmym tygodniem życia. Do trzeciego – czwartego roku ślepocie zmierzchowej nie towarzyszą zmiany struktury dna oka. Po kilku latach trwania choroby obserwowany jest proces stopniowej degeneracji siatkówki, prowadzący do utraty widzenia również w jasnym, dziennym świetle (12). U psów chorych na CSNB stwierdza się odbiegającą od normy elektroretinografię. Zapisana fala ma kształt prawidłowy ale znacznie zmniejszoną amplitudę. Przyczyną choroby są mikrodelecje w genie RPE65 (11,12). Białko to potrzebne jest do syntezy retinolu w komórkach fotoreceptorów. Brak jego sprzyja akumulacji estrów retinolu w postaci kropli tłuszczu w komórkach pigmentowych siatkówki. Uszkodzony nabłonek barwnikowy siatkówki zaburza proces fototransdukcji (12). Kolejną chorobą zwyrodnieniową siatkówki jest schorzenie określane terminem centralne postępujące zwyrodnienie siatkówki (CPRD – central progressive retinal degeneration). W tej jednostce chorobowej uszkodzeniu ulega nabłonek barwnikowy siatkówki (4). Nabłonek ten odpowiada za niszczenie zużytych bądź uszkodzonych fotoreceptorów oraz za wytwarzanie nowych (1,4). Proces chorobowy dotyczy obu oczu równocześnie, ale zmiany powstające w siatkówce nie są tak symetryczne jak przy PRA (2). Zwyrodnienie nabłonka pigmentowego siatkówki zaburza funkcje neurosiatkówki. CPRD dziedziczone jest w sposób autosomalny dominujący (9). Choroba występuje głównie w Europie u psów myśliwskich i pracujących między innymi u labradorów, retriverów, cocker spanieli, border collie (2,3). Początkowo zmiany chorobowe uwidaczniają się w centralnej części siatkówki, co prowadzi do utraty centralnego widzenia przy zachowanym widzeniu obwodowym. Chory pies nie dostrzega obiektów stacjonarnych, ale ruchome widzi dobrze np. lecącego ptaka. W CPRD utrata wzroku postępuje znacznie wolniej niż przy PRD i brak jest objawów ślepoty zmierzchowej. W trakcie trwania choroby siatkówka oka staje się cieńsza, zanikają naczynia krwionośne a tarcza nerwu wzrokowego ulega dystrofii. Do przyspieszonego rozwoju CPRD przyczynia się niedobór oraz zaburzenia w metabolizmie i transporcie witaminy E. Rola witaminy E, jako antyoksydanta, polega na ochronie fotoreceptorów przed uszkodzeniem przez silny bodziec świetlny (13). Szeroko rozpowszechnioną chorobą siatkówki oka psa jest dysplazja siatkówki (RD – retinal dysplasja) (4). Jest to schorzenie dziedziczone z rodziców na potomstwo w sposób dominujący (9). Chorobie sprzyjają niedobory witaminy A (10). Najczęściej notuje się ją u labradorów, angielskich spanieli, terierów, beagli (4). W zależności od stopnia nasilenia zmian chorobowych w siatkówce, w chorobie różnicujemy trzy formy kliniczne; łagodną, geograficzną i formę dysplazji z rozwarstwieniem siatkówki (9). Większość psów najczęściej przejawia łagodną formę RD, która nie upośledza widzenia. U takich psów na dnie oka widoczne są pojedyncze fałdy siatkówki (10). W formie geograficznej dysplazji siatkówki występują znaczne pofałdowania, mają one zwykle kształt linearny bądź litery Y. W trzeciej formie dysplazji cała siatkówka jest rozwarstwiona i uszkodzona, dodatkowo powstają ogniska depigmentacji. W postaci tej ciało szkliste oka ulega rozwodnieniu (synereza), (10). Dwie ostatnie formy dysplazji siatkówki prowadzą do ślepoty. Zmiany kliniczne w oczach można zaobserwować już między ósmym a szesnastym tygodniem życia (2). RD dodatkowo towarzyszą zmiany w oczach takie jak katarakty, wynaczynienia, powiększenie lub zmniejszenie gałki ocznej (10). U psów rasy labrador retriver często występuje syndrom oculochondrodysplastyczny, w którym oprócz zmian charakterystycznych dla dysplazji siatkówki mamy również do czynienia z dysplazją kości piszczelowej, strzałkowej, łokciowej i promieniowej (3,9).
Do grupy chorób siatkówki oka psa, przekazywanych z rodziców na potomstwo, zaliczamy też schorzenie określane terminem anomalia oka collie (CEA – collie eye anomaly). Zaburzenie to dziedziczone jest w sposób autosomalny resesywny (14). W jednostce tej nie obserwuje się narastania objawów choroby wraz z postępującym wiekiem psa. Chorobę tę spotykamy głównie u psów rasy owczarek; szkocki, szetlandzki, border, australijski oraz u mieszańców tych ras (5,15,16). Prawdopodobnie występuje u ok. 90% populacji tych psów (4). U większości owczarków obarczonych genem CEA zmiany kliniczne w oczach są nikłe, a więc stopień upośledzenia widzenia jest mały (17). U psów znacznie dotkniętych chorobą, już w pierwszym roku ich życia siatkówka ulega rozwarstwieniu. Psy takie są ślepe. Stopień uszkodzenia oka zależny jest od skali zaburzeń w procesie różnicowania mezodermalnego (14). W zależności od stopnia zmian klinicznych w oku, wyróżniamy trzy postacie CEA. (17). Forma pierwsza ma charakter łagodny. Zmiany w oku dotyczą warstwy naczyniowej oka, która ulega hypoplazji. W centralnej części naczyniówki obserwowane są zmiany koloru i pigmentacji. Większość psów z tą postacią choroby funkcjonuje normalnie (14). Czasami postać ta może mieć ukryty przebieg tzn. była notowana u szczeniaka, a w wieku dorosłym tegoż psa jest nierozpoznawalna. Dzieje się tak na skutek wytworzenia w siatkówce pigmentu, który maskuje obraz hypoplazji naczyniówki (17). Pomimo braku objawów CEA , psy te ciągle są nosicielami genu CEA i należy wykluczyć je z hodowli. W drugiej formie CEA, oprócz zmian opisanych powyżej, w tarczy nerwu wzrokowego stwierdza się uszkodzenia w postaci szczelin, garbiaków. Postać ta notowana jest u ok. 25% psów dotkniętych genem CEA (16,17). W trzeciej formie choroby mamy do czynienia z rozwarstwieniem siatkówki , wylewami krwi dochodzącymi nawet do przedniej komory oka (14,17). Naczynia krwionośne dna oka stają się cienkie, zniekształcone i ostatecznie zanikają. W postaci tej stwierdza się nieprawidłową budowę twardówki, naczyniówki, siatkówki oka. Występuje u ok. 5-10% psów z genem CEA. (16).
Niezakaźną chorobą oka psa jest tzw. zwyrodnienie siatkówki powodujące nagłą ślepotę (SARD – sudden acquired retinal degeneration), (18). Choroba ta cechuje się nagłym przebiegiem. Prowadzi do utraty widzenia w obu oczach równocześnie w ciągu pierwszej lub kolejnej doby od wystąpienia schorzenia (19). Nagłej ślepocie początkowo nie towarzyszą żadne zmiany w obrazie klinicznym dna oka ale w późniejszym okresie pojawiają się zmiany charakterystyczne dla procesu zwyrodnienia siatkówki (18). Choroba występuje u psów w wieku średnim i starszym, zwykle u psów mających nadwagę. Zdecydowaną większość stanowią osobniki płci żeńskiej, wszystkich ras. Chorobie oka towarzyszy polidypsja, poliuria, polifagia oraz nyctalpia. Odruch źreniczny jest spowolniony, a źrenica w spoczynku jest rozszerzona (20). Diagnozę stawia się na podstawie badania retinografem, którym potwierdza się brak odpowiedzi fotoreceptorów na sygnał świetlny (18). W SARD następuje szybkie i gwałtowne uszkodzenie komórek fotoreceptorowych siatkówki. Uszkodzenia te powodowane są nadmiarem toksyn (18) i uruchomionym procesem apoptozy (program zapisany w komórkach prowadzający do ich śmierci ), (19). U psów dotkniętych SARD występują objawy choroby Cushinga a w ich krwi obwodowej stwierdza się naprzemiennie wysokie, stężenie kortyzolu i hormonów płciowych (21). Wzrost ten powodowany może być wpływem długotrwałego stresu. Pomimo objawów sugerujących chorobę Cushinga tylko u ok. 20% psów jest ona diagnozowana (20). Wysokie stężenie kortyzoli we krwi zwiększa napływ jonów Ca2+ do wnętrza komórek fotoreceptorowych. Nadmiar jonów Ca2+ przy udziale wolnych rodników tlenowych uszkadza błony mitochondrialne. Uwolnione w ten sposób enzymy uruchomiają apoptozę prowadząc do śmierci komórki (19). SARD jest chorobą która , powoduje nieodwracalne zmiany w oczach , a także uszkadza wiele narządów wewnętrznych. U takich psów dochodzi między innymi do zwyrodnienia wątroby, niewydolności nerek, uszkodzenia szpiku kostnego, tarczycy (20). W praktyce klinicznej lekarz weterynarii coraz częściej spotyka się z chorobami oczu u psów. Występują one pod wieloma postaciami i dotyczą różnych struktur narządu wzroku. Poznanie podłoża, w tym również molekularnego, pozwala opracować nowoczesne metody diagnostyki i leczenia. Zbadano i opracowano już szereg testów genetycznych dla niektórych chorób u niektórych ras psów. Testy te pozwalają na szybką i pewną diagnostykę co potrzebne jest do eliminacji z hodowli chorych osobników i ograniczenia w ten sposób liczby nosicieli mutacji. Informacje na temat rodzajów testów genetycznych w kierunku chorób oczu u psów i sposobu ich wykonywania dostępne są na stronie internetowej www.optigen.com
PIŚMIENNICTWO
-
Miller P.E., Murphy Ch.J. Vision in dogs.1995. JAVMA, 207, 12, 1623.
-
Narfstrom K., Ekesten B. Diseases of the canine fundus. 1999. In Vet. Ophtalm. Ed. Gelatt K.N. Baltimore, 869.
-
Slater D. Retina. 2001. Chapter 16. In Fundamentals of Vet. Ophtalm. 3- erd ed. WB Sanders Ca, Philadelphia. 419.
-
Martin C.L. 2005. Ophtalmic Disease. Vet. Med. Manson Publications.
-
Gough A., Alison T. Breed predispositions to disease in dogs and cats. 2004. Blackwell Publication, 121.
-
Petersen-Jones S. Current DNA based tests for heredietary eye disease. 2001. Vet. Ophtalm.4, 233
-
Acland G.M., Ray K., Aquirre G.D. Exclusion of the cyclic GMP-PDF beta subunits gene as a candidate in the prcd-dog. 1995. ARVO Abstract. Inv. Ophtalm. Vis. Sci, 36, 4090.
-
Acland G.M., Blanton S.H., Hersbfield M and Aquirre G. A canine retinal degeneration sa a X-linked trait. 1994. Am. J Med. Gen. 52, 27.
-
Kaya M. Disease of the retina in dogs and cats. 2000. J Turk. Vet. Surg. Ass. 6,89.
-
Grahn B.H., Storey E.S., McMillan C. Inherited retinal dysplasia and persistent hyperplastic primary vitreous in miniature schnauzer dogs. 2004. Vet. Ophtalm., 7, 151.
-
Świtoński M., Konieczny P., Klukowski J., Janyga B. Aquirre C. Mikrodelecje w genie RPE65 wywołujące dziedziczną dystrofię siatkówki u polskiej populacji rasy briard. 2002. Med. Wet. 58, 946.
-
Wirgstad A., Narfstrom K., Nilsson S.E. Slowly progressive changes of the retina and retinalpigment epithelium in briard dogs with heredietary retinal dystrophy. A morphological study. 1994. Doc. Ophtalm., 87, 337.
-
McLellan G.J.,Elks R.,Lybaert P., Wattle C., Moore D.L., Bedford P.G. Vit. E deficiency in dogs with retinal RPE dystrophy. 2002. Vet. Rec., 151, 663.
-
Bedford P.G. CEA in the Lancashire heeler. 1998. Vet. Rec., 26, 143, 354.
-
Rampazzo A., D’Angela A., Capucchio M.T., Serem S. Collie eye anomaly in a mixed-breed dog. 2005. Vet. Ophtalm. 8,5, 357.
-
Sargan D.R. CEA in the rough collie. 2001. J Small Animal Practice. 42, 204.
-
Mar C. Collie eye anomaly. 2006. The Occular Outlook,5, 1, 2.
-
Van der Woerdt A., Nassise M.P.,Davidson M.G. SARD in the dogs; clincal findings in 36 cases. 1991. Progress in Comp. Ophtalm. 1, 11.
-
Miller P.E., Galbreath E.J., Kenren I.C., Steinberg H. Dubielzig R.R. Photoreceptor cell death by apoptosis in dog with SARD. 1998. Abstract in Am. J Vet. Res. 59, 149.
-
Lewin C.D. SARD. 2006. Pending Publications in Dogs, Diet and Disease. 2nd ed. X.
-
Carter R.T.,Beutley E., Oliver J.W., Miller P.E., Herring I.P. Elevation in adrenal sex hormones in canine SARD (abstract) 2003. 34th Ann. Meeting of the College Ophtalm. 34, 40.


 „ALGEBRUSH II” jest to bardzo przydatne narzędzie do zdejmowania chorego nabłnka rogówki, usuwania martwaków u kotów. Można je także wykorzystywać do wyjmowania ciał obcych z rogówki, w tym metalowych.
„ALGEBRUSH II” jest to bardzo przydatne narzędzie do zdejmowania chorego nabłnka rogówki, usuwania martwaków u kotów. Można je także wykorzystywać do wyjmowania ciał obcych z rogówki, w tym metalowych.